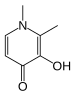
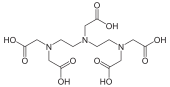
Komplekslerin kararlılık sabitleri - Stability constants of complexes
Bir kararlılık sabiti (oluşum sabiti, bağlanma sabiti) bir bir denge sabiti bir oluşumu için karmaşık çözelti içinde. Kompleksi oluşturmak için bir araya gelen reaktifler arasındaki etkileşimin gücünün bir ölçüsüdür . İki ana kompleks türü vardır: bir metal iyonunun bir ligand ile etkileşimi ile oluşan bileşikler ve konak-konuk kompleksleri ve anyon kompleksleri gibi supramoleküler kompleksler. Kararlılık sabiti(ler)i, çözeltideki kompleks(ler)in konsantrasyon(lar)ını hesaplamak için gerekli bilgiyi sağlar. Kimya, biyoloji ve tıpta birçok uygulama alanı vardır.
Tarih
Jannik Bjerrum ( Niels Bjerrum'un oğlu ), metal-amin komplekslerinin kararlılık sabitlerinin belirlenmesi için ilk genel yöntemi 1941'de geliştirdi. Bunun böyle geç bir tarihte, Alfred Werner için doğru yapıları önermesinden yaklaşık 50 yıl sonra meydana gelmesinin nedenleri . koordinasyon kompleksleri , Beck ve Nagypál tarafından özetlenmiştir. Bjerrum'un yönteminin anahtarı , çözeltideki hidrojen iyonlarının konsantrasyonunu belirlemek için son zamanlarda geliştirilen cam elektrot ve pH metrenin kullanılmasıydı . Bjerrum, bir ligandla bir metal kompleksi oluşumunun bir tür asit-baz dengesi olduğunu fark etti: metal iyonu Mn + ile hidrojen iyonu H + arasında ligand L için bir rekabet var . Bu, dikkate alınması gereken iki eşzamanlı denge olduğu anlamına gelir. Aşağıda, genellik adına elektrik yükleri ihmal edilmiştir. İki denge
Bu nedenle, bir esnasında hidrojen iyonu konsantrasyonunu izleyerek titrasyon ile M ve HL bir karışımının baz ve bilerek asit ayrışma sabiti HL, ML oluşumu için kararlılık sabiti belirlenebilir. Bjerrum, birçok kompleksin oluşabileceği sistemler için kararlılık sabitlerini belirlemeye devam etti.
Takip eden yirmi yıl, belirlenen kararlılık sabitlerinin sayısında gerçek bir patlama gördü. Gibi İlişkiler, Irving-Williams serisi keşfedildi. Hesaplamalar, sözde grafik yöntemler kullanılarak elle yapıldı. Bu dönemde kullanılan yöntemlerin altında yatan matematik Rossotti ve Rossotti tarafından özetlenmiştir. Bir sonraki önemli gelişme, hesaplamaları yapmak için bir bilgisayar programı olan LETAGROP'un kullanılmasıydı. Bu, elle hesaplamalarla değerlendirilemeyecek kadar karmaşık sistemlerin incelenmesine izin verdi. Daha sonra, SCOGS ve MINIQUAD gibi genel olarak karmaşık dengeleri ele alabilen bilgisayar programları geliştirildi, böylece bugün kararlılık sabitlerinin belirlenmesi neredeyse "rutin" bir işlem haline geldi. Binlerce kararlılık sabitinin değerleri iki ticari veritabanında bulunabilir.
teori
Bir metal iyonu (M) ve bir ligand (L) arasında bir kompleksin oluşumu aslında genellikle bir ikame reaksiyonudur. Örneğin, sulu çözeltilerde metal iyonları aquo iyonları olarak bulunacaktır , bu nedenle ilk kompleksin oluşumu için reaksiyon şu şekilde yazılabilir:
Denge sabiti Bu reaksiyon için verilir
[L], "L'nin konsantrasyonu" olarak ve köşeli parantez içindeki diğer terimler için de aynı şekilde okunmalıdır. İfade, sabit olan terimleri çıkararak büyük ölçüde basitleştirilebilir. Her metal iyonuna bağlı su moleküllerinin sayısı sabittir. Seyreltik çözeltilerde suyun konsantrasyonu etkin bir şekilde sabittir. ifade olur
Bu sadeleştirmenin ardından genel denge için genel bir tanım verilebilir.
Tanım, herhangi bir sayıda reaktifi içerecek şekilde kolayca genişletilebilir. Reaktiflerin her zaman bir metal ve bir ligand olması gerekmez, ancak bir kompleks oluşturan herhangi bir tür olabilir. Bu şekilde tanımlanan kararlılık sabitleri, ilişki sabitleridir. Bu gibi bazı karışıklığa yol açabilecek p K bir değerler vardır ayrışma sabitleri. Genel amaçlı bilgisayar programlarında, tüm sabitleri ilişki sabitleri olarak tanımlamak gelenekseldir. İki tür sabit arasındaki ilişki , birleşme ve ayrışma sabitleri olarak verilir .
Adımsal ve kümülatif sabitler
β sembolü verilen bir kümülatif veya genel sabit, reaktiflerden bir kompleksin oluşumu için sabittir. Örneğin, ML 2 oluşumu için kümülatif sabit şu şekilde verilir:
- ;
Adım adım sabitleri, K 1 ve K 2 seferinde kompleksleri bir adım oluşumu.
- ;
- ;
Bunu takip ediyor
Kümülatif bir sabit her zaman adımlı sabitlerin ürünü olarak ifade edilebilir. Tersine, herhangi bir kademeli sabit, iki veya daha fazla toplam sabitin bir bölümü olarak ifade edilebilir. K gibi bir sembol olsa da, adımlı sabitler için üzerinde anlaşmaya varılmış bir gösterim yoktur.L
MLbazen literatürde bulunur. Yukarıda gösterildiği gibi her bir kararlılık sabitini açıkça belirtmek iyi bir uygulamadır.
hidroliz ürünleri
Bir hidrokso kompleksinin oluşumu, bir hidroliz reaksiyonunun tipik bir örneğidir. Bir hidroliz reaksiyonu, bir substratın suyla reaksiyona girerek bir su molekülünü hidroksit ve hidrojen iyonlarına ayırdığı reaksiyondur. Bu durumda hidroksit iyonu daha sonra substrat ile bir kompleks oluşturur.
- ;
Suda konsantrasyonu hidroksit ile hidrojen iyonlarının konsantrasyonu ile ilişkili olan kendine iyonizasyon sabiti , K w .
Hidroksit konsantrasyonu ifadesi, oluşum sabiti ifadesi ile değiştirilir
Genel olarak, reaksiyon için
Daha eski literatürde, log K değeri genellikle bir hidroliz sabiti için belirtilir. Log β * değeri genellikle M p L q (OH) r jenerik kimyasal formülü ile hidrolize edilmiş bir kompleks için belirtilir .
Asit-baz kompleksleri
Bir Lewis asidi , A ve bir Lewis bazı , B'nin bir AB kompleksi oluşturduğu düşünülebilir.
Lewis asitlerinin ve bazlarının kuvveti ve aralarındaki etkileşimlerle ilgili üç ana teori vardır.
- Sert ve yumuşak asit-baz teorisi ( HSAB ). Bu esas olarak niteliksel amaçlar için kullanılır.
- Drago ve Wayland, çok sayıda adüktün standart oluşum entalpisini oldukça doğru bir şekilde tahmin eden iki parametreli bir denklem önerdi. -Δ H ⊖ (A - B) = E bir E B + C bir Cı- B . Değerleri E ve C parametreleri mevcuttur.
- Guttmann donör numaraları : bazlar için sayı, bazın solvent olarak 1,2-Dikloroetan içinde antimon pentaklorür ile reaksiyonunun entalpisinden türetilir . Asitler için, asidin trifenilfosfin oksit ile reaksiyon entalpisinden bir alıcı numarası türetilir .
Daha fazla ayrıntı için bakınız: asit-baz reaksiyonu , asit katalizi , Ekstraksiyon (kimya)
Termodinamik
Metal iyon kompleksi oluşumunun termodinamiği çok önemli bilgiler sağlar. Özellikle entalpik ve entropik etkileri ayırt etmede yararlıdır . Entalpik etkiler bağ kuvvetlerine bağlıdır ve entropik etkiler bir bütün olarak çözümün düzenindeki/düzensizliğindeki değişikliklerle ilgilidir. Aşağıdaki şelat etkisi, termodinamik açısından en iyi şekilde açıklanmaktadır.
Bir denge sabiti, reaksiyon için standart Gibbs serbest enerji değişimi ile ilgilidir.
R, bir gaz sabiti ve T ise mutlak sıcaklık . 25 °C'de, Δ G ⊖ = (−5.708 kJ mol −1 ) ⋅ log β . Serbest enerji, bir entalpi terimi ve bir entropi teriminden oluşur.
Standart entalpi değişimi , kalorimetrik yöntem tercih edilse de, kalorimetri veya Van 't Hoff denklemi kullanılarak belirlenebilir . Hem standart entalpi değişimi hem de kararlılık sabiti belirlendiğinde, standart entropi değişimi yukarıdaki denklemden kolayca hesaplanır.
Çeşidi ML komplekslerinin adım adım oluşumu sabitleri olması , n büyüklük azalma gibi , n artar kısmen olabilir entropi faktörü açısından açıklanmıştır. Oktahedral komplekslerin oluşumunu ele alalım .
İlk adım için m = 6, n = 1 ve ligand 6 bölgeden birine gidebilir. İkinci adım için m = 5 ve ikinci ligand sadece 5 bölgeden birine gidebilir. Bu, ilk adımda ikinciye göre daha fazla rastgelelik olduğu anlamına gelir; Δ S ⊖ daha pozitif, dolayısıyla Δ G ⊖ daha negatif ve . Adımsal kararlılık sabitlerinin oranı bu temelde hesaplanabilir, ancak deneysel oranlar tam olarak aynı değildir çünkü Δ H ⊖ her adım için mutlaka aynı değildir. Bu kuralın istisnaları aşağıda #şelat etkisi ve #Geometrik faktörlerde tartışılmaktadır .
İyonik kuvvet bağımlılığı
Termodinamik denge sabiti K ⊖ denge için,
olarak tanımlanabilir
Burada {ML} olan aktivite kimyasal türlerin ML vb K ⊖ olan boyutsuz aktivitesi boyutsuz olduğu. Ürünlerin aktiviteleri payda, reaktanların aktiviteleri paydada yer alır. Bu ifadenin bir türevi için aktivite katsayısına bakın .
Aktivite, konsantrasyon ve aktivite katsayısının ( γ ) çarpımı olduğundan tanım şu şekilde de yazılabilir:
burada [ML], ML konsantrasyonunu temsil eder ve Γ , aktivite katsayılarının bir bölümüdür. Bu ifade şu şekilde genelleştirilebilir:
Aktiviteleri kullanarak katılan komplikasyonları önlemek için, kararlılık sabiti vardır belirlenen , eğer mümkünse, bir arka plan bir çözeltiden oluşan bir ortam içinde , elektrolit , yüksek de iyonik kuvvet koşullar altında, bir, Γ her zaman sabit olduğu kabul edilebilir. Örneğin, ortam 0.1 mol dm -3 sodyum nitrat veya 3 mol dm -3 sodyum perklorat çözeltisi olabilir . Tüm Γ göz ardı edilebilir sürekli ve teorik olarak genel bir ifadedir, yukarıda elde edilir.
Yayınlanmış tüm stabilite sabiti değerleri, tespitlerinde kullanılan spesifik iyonik ortama atıfta bulunur ve karmaşık CuL (L = glisinat ) için gösterildiği gibi, farklı koşullar ile farklı değerler elde edilir . Ayrıca, kararlılık sabiti değerleri kullanılan spesifik elektrolite bağlıdır, çünkü Γ değeri aynı iyonik kuvvette bile farklı elektrolitler için farklıdır . Dengedeki türler ile arka plan elektroliti arasında herhangi bir kimyasal etkileşim olması gerekmez, ancak bu tür etkileşimler özel durumlarda meydana gelebilir. Örneğin, fosfatlar alkali metallerle zayıf kompleksler oluştururlar , bu nedenle ATP gibi fosfatları içeren stabilite sabitlerini belirlerken , kullanılan arka plan elektroliti örneğin bir tetrakilamonyum tuzu olacaktır. Başka bir örnek, halojenür ve diğer anyonlarla zayıf kompleksler oluşturan , ancak perklorat iyonlarıyla olmayan demir(III) içerir .
Yayınlanmış sabitler, belirli bir uygulama için gerekli olandan farklı bir iyonik kuvvete atıfta bulunduğunda, spesifik iyon teorisi (SIT) ve diğer teoriler vasıtasıyla ayarlanabilirler .
Sıcaklık bağımlılığı
Van 't Hoff denklemine göre tüm denge sabitleri sıcaklığa göre değişir
Alternatif olarak
R, bir gaz sabiti ve T termodinamik sıcaklıktır. Böylece, standart entalpi değişiminin Δ H ⊖ negatif olduğu ekzotermik reaksiyonlar için , K sıcaklıkla azalır, ancak Δ H ⊖ pozitif olduğu endotermik reaksiyonlar için , K sıcaklıkla artar.
Komplekslerin kararlılık sabitlerini etkileyen faktörler
şelat etkisi
Arasında, sulu çözelti içinde, iki dengeyi dikkate alın bakır (II) iyonu, Cu + 2 ve etilendiamin , bir yandan ve ilgili (tr) metilamin , MeNH 2 diğer.
İlk reaksiyonda, iki dişli ligandı etilen diamin, bakır iyonu ile bir şelat kompleksi oluşturur. Şelasyon, beş üyeli bir halka oluşumu ile sonuçlanır. İkinci reaksiyonda, iki dişli ligand, yaklaşık olarak aynı donör gücüne sahip iki tek dişli metilamin ligandı ile değiştirilir ; bu, Cu-N bağlarının oluşum ısısının iki reaksiyonda yaklaşık olarak aynı olduğu anlamına gelir . Bakır konsantrasyonlarının eşit olduğu koşullar altında ve bu durumda metilamin konsantrasyonu, etilendiamin konsantrasyonunun iki katı olduğunda, iki dişli kompleksin konsantrasyonu, 2 tek dişli ligandlı kompleksin konsantrasyonundan daha büyük olacaktır. Etki, şelat halkalarının sayısıyla artar , bu nedenle altı şelat halkasına sahip EDTA kompleksinin konsantrasyonu, iki tek dişli nitrojen donör ligandı ve dört tek dişli karboksilat ligandlı karşılık gelen bir kompleksten çok daha yüksektir. Böylece, şelat etkisi fenomeni kesin olarak belirlenmiş bir ampirik gerçektir: karşılaştırılabilir koşullar altında, bir şelat kompleksinin konsantrasyonu, tek dişli ligandlarla benzer bir kompleksin konsantrasyonundan daha yüksek olacaktır.
Termodinamik büyük denge sabiti, kompleksin daha yüksek konsantrasyonda: şelat etkisini açıklayan yaklaşım için denge sabitini dikkate alır.
Tüm analitik konsantrasyonu metilamin iki katı etilendiamin ve bakır konsantrasyonu, konsantrasyon her iki tepkimesinde aynıdır [Cu (tr)] 2+ çok daha yüksek konsantrasyondan daha [Cu (MeNH 2 ) 2 ] + 2 için β 11 ≫ β 12 .
İki kararlılık sabiti arasındaki fark, temel olarak standart entropi değişimindeki farktan kaynaklanır , Δ S ⊖ . Şelatlayıcı ligand ile reaksiyonda solda iki tane, sağda bir tane partikül bulunurken, tek dişli ligand ile denklemde solda üç tane sağda bir tane partikül bulunur. Bu , şelat kompleksi oluştuğunda, monodentat ligandlarla kompleks oluşturulduğunda olduğundan daha az düzensizlik entropisinin kaybolduğu anlamına gelir . Bu, entropi farkına katkıda bulunan faktörlerden biridir. Diğer faktörler, çözünme değişiklikleri ve halka oluşumunu içerir. Etkiyi göstermek için bazı deneysel veriler aşağıdaki tabloda gösterilmektedir.
Denge günlük β Δ G ⊖ /kJ mol -1 Δ H ⊖ /kJ mol -1 − T Δ S ⊖ /kJ mol -1 Cd + 2 + 4 MeNH 2 ⇌ Cd (MeNH
2)2+
46.55 -37.4 -57.3 19.9 Cd 2+ + 2 tr ⇌ Cd(tr)2+
210.62 -60.67 -56.48 -4,19
Bu veriler, standart entalpi değişikliklerinin aslında iki reaksiyon için yaklaşık olarak eşit olduğunu ve şelat kompleksinin çok daha kararlı olmasının ana nedeninin, standart entropi teriminin çok daha az elverişsiz olması, aslında bu durumda elverişli olmasıdır. Genel olarak, moleküler düzeyde çözeltideki değişiklikler açısından termodinamik değerleri kesin olarak açıklamak zordur, ancak şelat etkisinin ağırlıklı olarak entropinin bir etkisi olduğu açıktır. Schwarzenbach'ınki de dahil olmak üzere diğer açıklamalar Greenwood ve Earnshaw'da tartışılmıştır.
Şelat halkalarının sayısı arttıkça şelat etkisi de artar. Örneğin, [Ni(dien) 2 )] 2+ kompleksi, [Ni(en) 3 )] 2+ kompleksinden daha kararlıdır ; her iki kompleks de nikel iyonu çevresinde altı nitrojen atomu ile oktahedraldir, ancak dien ( dietilentriamin , 1,4,7-triazaheptan) bir tridentat liganddır ve en iki dişlidir . Şelat halkalarının sayısı, liganddaki donör atomların sayısından bir eksiktir. EDTA (etilendiamintetrasetik asit) altı verici atoma sahiptir, bu nedenle beş şelat halkası ile çok güçlü kompleksler oluşturur. Sekiz verici atoma sahip olan DTPA gibi ligandlar , genellikle 8- veya 9-koordinat kompleksleri oluşturan lantanid veya aktinit iyonları gibi büyük metal iyonlarıyla kompleksler oluşturmak için kullanılır . 5 üyeli ve 6 üyeli şelat halkaları en kararlı kompleksleri verir. 4 üyeli halkalar, halka arasındaki bağ açısının küçük olması nedeniyle iç gerilmeye maruz kalır. 7 ve 8 üyeli halkalarda şelat etkisi de azalır, çünkü daha büyük halkalar daha az rijit olduğundan, onları oluştururken daha az entropi kaybolur.
Alifatik –OH gruplarının deprotonasyonu
Bir alifatik –OH grubundan bir protonun çıkarılması, bu işlem için gereken enerji oldukça büyük olduğundan sulu çözeltide elde etmek zordur. Bu nedenle, alifatik –OH gruplarının iyonlaşması, sulu çözeltide sadece özel durumlarda meydana gelir. Bu tür bir durum, H ihtiva eden bileşikler ile bulunan 2 N = C-C-OH alt yapı. Örneğin, içeren bileşikler 2-aminoetanol alt yapı protonu giderilmiş formu, H metal şelat kompleksleri oluşturabilen 2 N = C-C = O - . Şelat etkisi –OH bağını kırmak için gereken ekstra enerjiyi sağlar.
Tris molekülü ile ilgili önemli bir örnek ortaya çıkar . Fe 3+ ve Cu 2+ gibi iyonlarla şelat kompleksleri oluşturacağından bu molekül bir tampon ajanı olarak dikkatli kullanılmalıdır .
makrosiklik etki
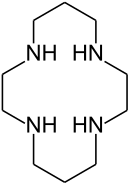
Makrosiklik ligand siklam (1,4,8,11-tetraazasiklotetradekan) ile bakır(II) kompleksinin stabilitesinin, karşılık gelen açık zincirli amin ile kompleksin stabilitesine kıyasla beklenenden çok daha büyük olduğu bulundu. . Bu fenomene " makrosiklik etki " adı verildi ve aynı zamanda bir entropi etkisi olarak yorumlandı. Bununla birlikte, daha sonraki çalışmalar, hem entalpi hem de entropi faktörlerinin dahil olduğunu ileri sürdü.
Makrosiklik ligandlar ve açık zincirli (şelatlayıcı) ligandlar arasındaki önemli bir fark, bir kompleks oluşturulduğunda metal iyonunun girdiği boşluğun boyutuna bağlı olarak metal iyonları için seçiciliğe sahip olmalarıdır. Örneğin, taç eter 18-taç-6 , potasyum iyonu K + ile daha küçük sodyum iyonu Na + ile olduğundan çok daha güçlü kompleksler oluşturur .
Olarak hemoglobin bir demir (II) iyonlarının bir makrosiklik ile kompleks haline porfirin halkası. Hemoglobin makalesi , oksihemogloginin demir(III) içerdiğini yanlış bir şekilde belirtir. Hemoglobindeki demir(II)'nin düşük dönüşlü bir kompleks olduğu, oksihemoglobin'de ise yüksek dönüşlü bir kompleks olduğu artık bilinmektedir . Düşük dönüşlü Fe2 + iyonu, porhirin halkasının boşluğuna sıkıca oturur, ancak yüksek dönüşlü demir(II) önemli ölçüde daha büyüktür ve demir atomu makrosiklik ligand düzleminin dışına itilir. Bu etki, hemoglobinin biyolojik koşullar altında oksijeni geri dönüşümlü olarak bağlama yeteneğine katkıda bulunur. Olarak B12 , bir kobalt (II) iyonu, bir tutulur Corrin halkası . Klorofil , magnezyum(II)'nin makrosiklik bir kompleksidir.
|

|
| siklam | Porfin , en basit porfirin . |

|
| Yaygın taç eterlerinin yapıları : 12-taç-4 , 15-taç-5 , 18-taç-6 , dibenzo-18-taç-6 ve bir aza-taç eter |
geometrik faktörler
Birbirini takip eden adım adım oluşumu sabitleri K , n , örneğin ML gibi bir seri n ( n = 1, 2, ...) genellikle azalır n artar. Bu kuralın istisnaları, ML n komplekslerinin geometrisi serinin tüm üyeleri için aynı olmadığında ortaya çıkar . Klasik örnek, sulu çözeltide diamingümüş(I) kompleksi [Ag(NH 3 ) 2 ] + ' nın oluşumudur .
Bu durumda, K 2 > K 1 . Bunun nedeni, sulu çözeltide Ag + olarak yazılan iyonun aslında dört koordinatlı tetrahedral su türü [Ag(H 2 O) 4 ] + olarak var olmasıdır . Daha sonra ilk adım, tetrahedral kompleksi [Ag(NH 3 )(H 2 O) 3 ] + oluşturan amonyak ile bağlı bir su molekülünün yer değiştirmesini içeren bir ikame reaksiyonudur . İkinci adımda, tüm su ligandları kaybolur ve doğrusal, iki koordinatlı bir ürün [H 3 N–Ag–NH 3 ] + oluşur. Termodinamik verilerin incelenmesi, entropi değişimindeki farkın, iki kompleksleşme reaksiyonu için kararlılık sabitlerindeki farklılığa ana katkıda bulunduğunu göstermektedir.
| denge | Δ H ⊖ /kJ mol -1 | Δ S ⊖ /J K −1 mol −1 |
|---|---|---|
| Ag + + NH 3 ⇌ [Ag (NH 3 )] + | -21.4 | 8.66 |
| [Ag (NH 3 )] + + NH 3 ⇌ [Ag (NH 3 ) 2 ] + | -35.2 | -61.26 |
[Co(H 2 O) 6 ] 2+' dan [ CoCl 4 ] 2− oluşumunda olduğu gibi, değişimin oktahedralden dörtyüzlüye olduğu başka örnekler de mevcuttur .
Metal iyonlarının sınıflandırılması
Ahrland, Chatt ve Davies, metal iyonlarının, donör atomları azot , oksijen veya flor olan ligandlarla donor atomları fosfor , kükürt veya klor olan ligandlara göre daha güçlü kompleksler oluşturmaları durumunda A sınıfı ve tersi ise B sınıfı olarak tanımlanabileceğini öne sürdüler. NS. Örneğin, Ni + 2 formları daha güçlü olan kompleksler aminler ile daha fosfinler , ancak Pd + 2 formları aminlerle daha fosfinler daha güçlü kompleksleri. Daha sonra Pearson, sert ve yumuşak asitler ve bazlar teorisini (HSAB teorisi) önerdi. Bu sınıflandırmada A sınıfı metaller sert asitler, B sınıfı metaller ise yumuşak asitlerdir. Bakır(I) gibi bazı iyonlar sınırda olarak sınıflandırılır. Sert asitler, yumuşak bazlara göre sert bazlarla daha güçlü kompleksler oluşturur. Genel olarak, sert-sert etkileşimler doğada ağırlıklı olarak elektrostatiktir, oysa yumuşak-yumuşak etkileşimler doğada ağırlıklı olarak kovalenttir. HSAB teorisi, kullanışlı olmasına rağmen, yalnızca yarı niceldir.
Bir metal iyonunun sertliği oksidasyon durumu ile artar. Bu etkinin bir örneği, Fe gerçeği ile verilir 2+ ile daha güçlü kompleksler oluşturma eğilimindedir N -donor ile daha ligandlar O -donor ligandları, fakat tam tersi Fe için de geçerlidir 3+ .
iyon yarıçapının etkisi
Irving-Williams serisi yüksek bir dönüş birinci geçiş serilerinin oktahedral, iki değerlikli metal iyonunu belirtir. Komplekslerin kararlılıklarını sıraya koyar.
- Mn < Fe < Co < Ni < Cu > Zn
Bu düzenin çok çeşitli ligandlar için geçerli olduğu bulundu. Serinin açıklamasının üç kolu var.
- Yarıçapa Mn düzenli düşmesi beklenmektedir 2+ Zn 2+ . Bu normal periyodik eğilim olacaktır ve istikrardaki genel artışı açıklayacaktır.
- Kristal alan sabitleme enerji nikel bir maksimum manganez (II) için sıfırdan (CFSE) artar (II) eklenmiştir. Bu, kompleksleri giderek daha kararlı hale getirir. CFSE, çinko(II) için sıfıra döner.
- Bakır(II) için CFSE, nikel(II) için olduğundan daha az olmasına rağmen, oktahedral bakır(II) kompleksleri, ekstra stabiliteye sahip bir kompleks ile sonuçlanan Jahn-Teller etkisine tabidir .
İyonik yarıçapın etkisinin bir başka örneği, üç değerlikli lantanid iyonları dizisi boyunca belirli bir ligand ile komplekslerin kararlılığındaki sürekli artış, iyi bilinen lantanit büzülmesinin bir etkisi .
Uygulamalar
Kararlılık sabit değerlerinden çok çeşitli uygulamalarda yararlanılır. Şelasyon tedavisi , kan transfüzyonu yapılan β- talasemi hastalarında aşırı demir yüklenmesi gibi metalle ilgili çeşitli hastalıkların tedavisinde kullanılır . İdeal ligand, diğerlerine değil, hedef metal iyonuna bağlanır, ancak bu seçicilik derecesini elde etmek çok zordur. Sentetik ilaç deferipron , Mg 2+ , Ca 2+ ve Zn 2+ gibi insan vücudunda bulunan diğer iki değerli iyonlardan herhangi birine tercihli olarak Fe 3+'ya bağlanacak şekilde iki oksijen verici atoma sahip olarak seçicilik sağlar. . Pb 2+ ve Cd 2+ gibi iyonlarla zehirlenmenin tedavisi, ikisi de iki değerlikli iyonlar olduğundan ve seçiciliğin sağlanması daha zor olduğundan çok daha zordur. Wilson hastalığındaki fazla bakır, penisilamin veya Trietilen tetramin (TETA) ile uzaklaştırılabilir . DTPA , plütonyum zehirlenmesinin tedavisi için ABD Gıda ve İlaç Dairesi tarafından onaylanmıştır .
DTPA, MRI kontrast geliştirmede gadolinyum için kompleks oluşturucu bir ajan olarak da kullanılır . Bu durumda gereksinim, Gd 3+ çok toksik olduğundan kompleksin çok güçlü olmasıdır. Oktadentat ligandın büyük stabilite sabiti, serbest Gd 3+ konsantrasyonunun neredeyse ihmal edilebilir olmasını, kesinlikle toksisite eşiğinin oldukça altında olmasını sağlar . Ek olarak ligand, gadolinyum iyonu üzerindeki 9 koordinasyon bölgesinden sadece 8'ini işgal eder. Dokuzuncu bölge, kendisini çevreleyen sıvıyla hızla değiş tokuş yapan bir su molekülü tarafından işgal edilir ve paramanyetik kompleksi bir kontrast reaktifine dönüştüren bu mekanizmadır .
EDTA , çoğu iki değerlikli katyonlarla o kadar güçlü kompleksler oluşturur ki, birçok kullanım alanı bulur . Örneğin, kalsiyum ve magnezyum iyonlarını sekestre ederek su yumuşatıcı olarak hareket etmek için genellikle çamaşır tozunda bulunur.
Makrosiklik ligandların seçiciliği, bir iyon seçici elektrotun oluşturulması için bir temel olarak kullanılabilir . Örneğin , doğal olarak oluşan makrosiklik antibiyotik valinomisin kullanan potasyum seçici elektrotlar mevcuttur .
| deferipron | penisilamin | trietilentetramin , TETA | Etilendiamintetraasetik asit , EDTA |
| Dietilentriaminpentaasetik asit , DTPA | valinomisin | Tri- n -bütil fosfat |
Bir polimere bağlı şelatlayıcı ligandlar içeren chelex 100 gibi bir iyon değişim reçinesi , su yumuşatıcılarda ve kromatografik ayırma tekniklerinde kullanılabilir. Gelen çözücü ekstraksiyonu elektriksel olarak nötr komplekslerin oluşumu katyonları organik çözücü içine ekstre edilmesi için izin verir. İçin , örneğin , içinde nükleer yakıt yeniden işleme uranyum (VI) ve plütonyum (VI) 'ya kompleksleri olarak kerosen içine ekstre edilmiştir [MO 2 (TBP) 2 (NO 3 ) 2 ] (TBP = tri- n- butil fosfat ). Olarak faz transfer katalizi , organik bir çözücü içinde çözünür olan bir maddenin uygun bir ligand ilavesiyle çözünür yapılabilir. Örneğin potasyum permanganat oksidasyonları, sulu reaksiyon karışımına katalitik miktarda bir taç eter ve az miktarda organik çözücü ilave edilerek elde edilebilir, böylece oksidasyon reaksiyonu organik fazda gerçekleşir.
Tüm bu örneklerde, ligand, oluşan komplekslerin stabilite sabitleri temelinde seçilir. Örneğin, TBP nükleer yakıtın yeniden işlenmesinde kullanılır, çünkü (diğer nedenlerin yanı sıra) solvent ekstraksiyonunun gerçekleşmesi için yeterince güçlü, ancak uranil katyonunu nitrato kompleksleri olarak geri kazanmak için kompleksin nitrik asit tarafından yok edilebilecek kadar zayıf bir kompleks oluşturur, [UO 2 (NO 3 ) 4 ] gibi 2− sulu faza geri döner.
supramoleküler kompleksler
Supramoleküler kompleksler hidrojen bağı, hidrofobik kuvvetler, van der Waals kuvvetleri, π-π etkileşimleri ve elektrostatik etkiler tarafından bir arada tutulur ve bunların tümü kovalent olmayan bağ olarak tanımlanabilir . Uygulamalar arasında moleküler tanıma , konak-konuk kimyası ve anyon sensörleri bulunur .
Moleküler tanımada tipik bir uygulama, tripodal sübstitüe edilmiş bir üre molekülü ve çeşitli sakkaritler arasında oluşan kompleksler için oluşum sabitlerinin belirlenmesini içeriyordu . Çalışma, susuz bir çözücü ve NMR kimyasal kayma ölçümleri kullanılarak gerçekleştirilmiştir. Amaç, sakkaritlere göre seçiciliği incelemekti.
Kullanımının bir örneği, çok moleküllü gelişiminde kompleksleri chemosensors için duyusuna geçiş metali topluluklarından kullanımı ile sağlanır ATP .
Anyon kompleksleşmesi , anyonun uygun bir kafeste kapsüllenmesiyle elde edilebilir . Seçicilik, kafesin şekli tasarlanarak tasarlanabilir. Örneğin dikarboksilat anyonları, iki metal iyonu içeren büyük bir makrosiklik yapı içinde elipsoidal boşlukta kapsüllenebilir.
deneysel yöntemler
Bjerrum tarafından geliştirilen yöntem, ölçümlerin kesinliği büyük ölçüde artmasına rağmen bugün hala kullanılan ana yöntemdir. En yaygın olarak, metal iyonu ve yüksek iyonik kuvvetli bir ortamda ligandı içeren bir çözelti , önce ligandın tamamen protonlandığı noktaya kadar asitleştirilir . Bu çözelti daha sonra bir titre içindeki bir çözeltisi ile, genellikle bir bilgisayar kontrollü otomatik titrasyon cihazı vasıtasıyla, CO 2 içermeyen baz. Hidrojen iyonunun konsantrasyonu veya aktivitesi , bir cam elektrot vasıtasıyla izlenir. Hesaplama için kullanılan veri seti üç bileşene sahiptir: sistemin modeli olarak adlandırılan mevcut olacak kimyasal türlerin doğasını tanımlayan bir ifade, titrasyonda kullanılan reaktiflerin konsantrasyonlarına ilişkin ayrıntılar ve son olarak da deneysel ölçümler. titre ve pH (veya emf ) çiftlerinin formu.
Diğer iyon seçici elektrotlar (ISE) kullanılabilir. Örneğin, bir metal iyonunun floro-komplekslerinin kararlılık komplekslerinin belirlenmesi ile bir florür elektrotu kullanılabilir.
İMKB kullanmak her zaman mümkün değildir. Bu durumda, titrasyon diğer ölçüm türleri tarafından izlenebilir. Ultraviyole-görünür spektroskopi , floresan spektroskopisi ve NMR spektroskopisi en sık kullanılan alternatiflerdir. Mevcut uygulama, bir dizi dalga boyunda absorbans veya floresan ölçümleri almak ve bu verileri aynı anda sığdırmaktır. Çeşitli NMR kimyasal kaymaları da birbirine takılabilir.
Kimyasal model ayrı deneylerde belirlenmiş olacaktır ligand protonasyon sabitleri, değerlerini, günlük için bir değer içerir K ağırlık ve oluşan komplekslerin bilinmeyen sabitlerinin tahminleri. Hesaplamada doğrusal olmayan en küçük kareler algoritması kullanıldığı için bu tahminler gereklidir . Tahminler genellikle kimyasal olarak benzer bir sistem referans alınarak elde edilir. Kararlılık sabiti veritabanları, ilgili kompleksler için yayınlanmış kararlılık sabiti değerlerinin bulunmasında çok yararlı olabilir.
Bazı basit durumlarda, hesaplamalar bir elektronik tabloda yapılabilir. Aksi takdirde genel amaçlı bilgisayar programları yardımıyla hesaplamalar yapılır. En sık kullanılan programlar şunlardır:
- Potansiyometrik ve/veya spektrofotometrik veriler: PSEQUAD
- Potansiyometrik veriler: HYPERQUAD , BEST, ReactLab pH PRO
- Spektrofotometrik veriler: HypSpec , SQUAD, SPECFIT, ReactLab EQUILIBRIA .
- NMR verileri HypNMR , WINEQNMR2
Biyokimyada, adüktlerin oluşum sabitleri İzotermal titrasyon kalorimetrisi (ITC) ölçümlerinden elde edilebilir . Bu teknik, denge için hem kararlılık sabitini hem de standart entalpi değişimini verir. Çoğunlukla, yazılımın mevcudiyeti ile 1:1 stokiyometri kompleksleriyle sınırlıdır.
Kritik olarak değerlendirilen veriler
Aşağıdaki referanslar, çeşitli ligand sınıfları için yayınlanmış stabilite sabitlerinin kritik incelemeleri içindir. Tüm bu incelemeler IUPAC tarafından yayınlanmıştır ve tam metin ücretsiz olarak pdf formatında mevcuttur.
- etilendiamin (tr)
- Nitrilotriasetik asit (NTA)
- aminopolikarboksilik asitler (kompleksler)
- Alfa hidroksi asitler ve diğer hidroksikarboksilik asitler
- polar yan zincirli amino asitler
- Genel
- Çevre açısından önemli ağır metallerin inorganik ligandlarla kimyasal özellikleri. Bölüm 1: Hg 2+ –Cl − , OH − , CO2−
3, SO2−
4ve PO3−
4 sistemler. - Çevre açısından önemli metallerin inorganik ligandlarla kimyasal özellikleri Bölüm 2: Cu 2+ –OH − , Cl − , CO2−
3, SO2−
4ve PO3−
4 sulu sistemler - Çevre açısından önemli metallerin inorganik ligandlarla kimyasal özellikleri Bölüm 3: The Pb 2+ –OH − , Cl − , CO2−
3, SO2−
4ve PO3−
4 sistemler - Çevre açısından önemli metallerin inorganik ligandlarla kimyasal özellikleri. Bölüm 4: Cd 2+ –OH − , Cl − , CO2−
3, SO2−
4ve PO3−
4 sistemler
veritabanları
- Ki Veritabanı ilaç ve reseptörleri için kimyasal bileşikler, nörotransmitter taşıyıcılar, iyon kanalları ve enzimlerin yayınlanan bağlanma afiniteleri (Ki), genel bir alan veri tabanıdır.
- BindingDB , esas olarak ilaç hedefleri olarak kabul edilen proteinin küçük, ilaca benzer moleküller ile etkileşimlerine odaklanan, ölçülen bağlanma afinitelerinin kamuya açık bir veri tabanıdır.
Referanslar
daha fazla okuma
Sigel, Roland KO; Skilandat, Miriam; Sigel, Astrid; Operschall, Bert P.; Sigel, Helmut (2013). "Bölüm 8. Şeker kalıntıları, nükleobazlar , fosfatlar , nükleotitler ve nükleik asitler ile kadmiyumun kompleks oluşumu ". Sigel, Astrid'de; Sigel, Helmut; Sigel, Roland KO (ed.). Kadmiyum: Toksikolojiden Temelliğe (PDF) . Yaşam Bilimlerinde Metal İyonları. 11 . Springer. s. 191–274. doi : 10.1007/978-94-007-5179-8_8 .
Sóvágo, Imre; Varnagy, Katalin (2013). "Bölüm 9. Amino asitlerin ve peptitlerin Kadmiyum(II) kompleksleri". Sigel, Astrid'de; Sigel, Helmut; Sigel, Roland KO (ed.). Kadmiyum: Toksikolojiden Temelliğe . Yaşam Bilimlerinde Metal İyonları. 11 . Springer. s. 275–302. doi : 10.1007/978-94-007-5179-8_9 . PMID 23430776 .
Yatsimirsky, Konstantin Borisoviç; Vasilyev, Vladimir Pavloviç (1960). Karmaşık Bileşiklerin Kararsızlık Sabitleri . Patterson, DA OUP tarafından çevrilmiştir.
Dış bağlantılar
- Stabilite sabitleri web sitesi : Deneysel titrasyonlar için bilgisayar programları, uygulamalar, veri tabanları ve donanım hakkında bilgi içerir.




![{\displaystyle \mathrm {[M(H_{2}O)} _{n}]+\mathrm {L} \leftrightharpoons \mathrm {[M(H_{2}O)} _{n-1}\mathrm {L} ]+\mathrm {H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6c90df793f368a962ab232a4d7445ea67cd553d)
![{\displaystyle \beta ^{'}={\frac {[\mathrm {M(H_{2}O)} _{n-1}\mathrm {L} ][\mathrm {H_{2}O} ] }{[\mathrm {M(H_{2}O)} _{n}][\mathrm {L} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb903e0c6849446ba718798c09f77751851f266c)
![\beta ={\mathrm {{\frac {[ML]}{[M][L]}}}}.](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6dbc7aecca141447456d84685c3544a3abf8308)

![{\displaystyle \beta _{pq...}={\frac {[\mathrm {M} _{p}\mathrm {L} _{q}...]}{[\mathrm {M} ]^ {p}[\mathrm {L} ]^{q}...}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9b5cb845f8efec1e7800490f0c4d0e5cd90a76e)

![{\displaystyle \beta _{1,2}=\mathrm {\frac {[ML_{2}]}{[M][L]^{2}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd0600d0b3496515a3e2b2ee1f26e7f6c0c7e0a6)

![{\displaystyle K_{1}=\mathrm {\frac {[ML]}{[M][L]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/abf3c8b4381157f0280c84e2286d574f3bf7f0dc)

![{\displaystyle K_{2}=\mathrm {\frac {[ML_{2}]}{[ML][L]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d69161b913579794614dbb05851b4cc739a3086)


![{\displaystyle K=\mathrm {\frac {[M(OH)]}{[M][OH]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/33c23271b9152d2329b562befa69300b63a0124c)
![{\displaystyle K_{w}=\mathrm {[H]} ^{+}\mathrm {[OH]} ^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b21309ca9983d911ba3326911e0bf14918f0f9a9)
![{\displaystyle K={\frac {[\mathrm {M} (\mathrm {OH} )]}{[\mathrm {M} ]K_{\mathrm {w} }[\mathrm {H} ]^{- 1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15c00635c0c40ce1c98b65ad70c173b71abeedf3)
![{\displaystyle \beta _{1,-1}^{*}=KK_{\mathrm {w} }={\frac {[\mathrm {M} (\mathrm {OH} )]}{[\mathrm { M} ][\mathrm {H} ]^{-1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7fadb3fd4aca5c5dc7ac61db7e320417f3b128b3)



![{\displaystyle ,K=\mathrm {\frac {[AB]}{[A][B]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/47949aaef3e5223551aade26d942897e76d70387)





![{\displaystyle K^{\ominus }=\mathrm {\frac {[ML]}{[M][L]}} \times {\frac {\gamma _{\mathrm {ML} }}{\gamma _ {\mathrm {M} }\gamma _{\mathrm {L} }}}=\mathrm {\frac {[ML]}{[M][L]}} \times \Gama }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73bd77587e27db8a47d8bf7dd244d05f84917022)
![{\displaystyle \beta _{pq...}^{\ominus }={\frac {[\mathrm {M} _{p}\mathrm {L} _{q}...]}{[\mathrm {M} ]^{p}[\mathrm {L} ]^{q}...}}\times \Gama }](https://wikimedia.org/api/rest_v1/media/math/render/svg/07fcbbe22a4e6a23444c531c7ae018239b2f481d)




![{\displaystyle \mathrm {Cu^{2+}+tr\rightleftharpoons [Cu(en)]^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/537a54fd90a52ed8cba49c5a78741e88fceedbda)
![{\displaystyle Cu^{2+}+2MeNH_{2}\rightleftharpoons [Cu(MeNH_{2})_{2}]^{2+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6078135f5afd5f03b40d01435a5ea40e9d2dee1d)
![{\displaystyle \mathrm {[Cu(en)]=\beta _{11}[Cu][tr]|} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e626081c150da6b692dd1bb8e07bec7e42b436c5)
![{\displaystyle \mathrm {[Cu(MeNH_{2})_{2}]=\beta _{12}[Cu][MeNH_{2}]} ^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/547473860966f88d473b83875f9a68480bc65010)


![{\displaystyle \mathrm {Ag^{+}+NH_{3}\rightleftharpoons [Ag(NH_{3})]^{+};K_{1}={\frac {[Ag(NH_{3})] }{[Ag][NH_{3}]}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0dde96e275d8d65b5467ef70aa8c99178407a943)
![{\displaystyle \mathrm {Ag(NH_{3})^{+}+NH_{3}\rightleftharpoons [Ag(NH_{3})_{2}]^{+};K_{2}={\frac {[Ag(NH_{3})_{2}]}{[Ag(NH_{3}][NH_{3}]}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f461e352164a1f5a3ed55eb58b7b415c4b53e261)