Ev sahibi-misafir kimyası - Host–guest chemistry
Gelen supramoleküler kimyanın , konak-konuk kimyası tarif kompleksler , iki ya da daha fazla oluşan moleküller veya iyonlar , tam olarak daha başka güçler tarafından özgü yapısal ilişkiler bir arada tutulur kovalent bağlar . Konak-misafir kimyası, moleküler tanıma ve kovalent olmayan bağlanma yoluyla etkileşimler fikrini kapsar . Kovalent olmayan bağlanma, proteinler gibi büyük moleküllerin 3B yapısının korunmasında kritik öneme sahiptir ve büyük moleküllerin spesifik olarak ancak geçici olarak birbirine bağlandığı birçok biyolojik süreçte yer alır.
Kovalent olmayan etkileşimler kabaca daha elektrostatik veya dağıtıcı katkılara sahip olanlara bölünebilse de, yaygın olarak bahsedilen birkaç kovalent olmayan etkileşim türü vardır: iyonik bağ , hidrojen bağı , van der Waals kuvvetleri ve hidrofobik etkileşimler .


genel bakış
Konak-misafir kimyası, bir konak molekülün bir konuk molekül veya iyon ile kimyasal bir bileşik oluşturduğu supramoleküler kimyanın bir dalıdır . Bileşiğin iki bileşeni, kovalent olmayan kuvvetlerle, en yaygın olarak hidrojen bağıyla bir arada tutulur . Ev sahibi ve konuk arasındaki bağ genellikle ilgili iki parçaya oldukça özeldir. Bu komplekslerin oluşumu moleküler tanıma konusunun merkezinde yer alır .
Konak ve misafirin birbirinden ayrı olduğu serbest durum ile yapısal olarak tanımlanmış bir konak-konuk kompleksinin olduğu bağlı durum arasında bir denge vardır:
- H = "ev sahibi", G = "misafir", HG = "ev sahibi–konuk kompleksi"
"Konakçı" bileşen, daha büyük molekül olarak kabul edilebilir ve daha küçük "misafir" molekülü kapsar. Biyolojik sistemlerde, benzer konak ve konuk terimleri, sırasıyla enzim ve substrat olarak adlandırılır.
Belirli işlevleri ve görevleri yerine getiren sentetik sistemler tasarlamak için ev sahibi ve konuk arasındaki bağlanmanın termodinamiğini anlamak çok önemlidir. Kimyacılar, farklı bağlanma etkileşimlerinin enerji alışverişine odaklanıyor ve NMR spektroskopisi, UV/görünür spektroskopisi ve izotermal titrasyon kalorimetrisi gibi çeşitli teknikleri kullanarak bu kovalent olmayan etkileşimlerin temel kökenlerini ölçmek için bilimsel deneyler geliştirmeye çalışıyorlar. Bağlanma sabiti değerlerinin nicel analizi, faydalı termodinamik bilgiler sağlar.
Ev sahibi-konuk etkileşimlerinin termodinamik ilkeleri
Konak-misafir kimyasının termodinamik faydaları, konak ve konuk moleküller arasındaki etkileşimden dolayı genel olarak daha düşük bir Gibbs serbest enerjisi olduğu fikrinden türetilmiştir . Kimyacılar, supramoleküler kimyada bulunan bu kovalent olmayan etkileşimlerin enerji ve termodinamik özelliklerini kapsamlı bir şekilde ölçmeye çalışıyorlar; ve bunu yaparak, supramoleküler yapı üzerinde genel bir etki yaratmak için kullanılan bu çok sayıda, küçük, kovalent olmayan kuvvetlerin kombinatoryal sonucu hakkında daha fazla bilgi edinmeyi umuyoruz.
Bir ilişki sabiti , ifade ile tanımlanabilir
{HG} dengedeki kompleksin termodinamik aktivitesidir . {H} ev sahibinin etkinliğini ve {G} misafirin etkinliğini temsil eder. Miktarları , ve karşılık gelen konsantrasyonlar ve bir bölüm olan aktivite katsayıları .
Pratikte denge sabiti genellikle konsantrasyonlar cinsinden tanımlanır.
Bu tanım kullanıldığında, aktivite katsayılarının bölümünün sayısal değerinin bir olduğu ima edilir . Daha sonra, denge sabitinin 1/konsantrasyon boyutuna sahip olduğu , ancak standart Gibbs serbest enerji değişimi nedeniyle bu doğru olamayacağı , K'nin logaritması ile orantılı olduğu görülür .
Bu bariz paradoks, boyutu, konsantrasyonlar bölümünün boyutunun karşılığı olarak tanımlandığında çözülür . Bunun anlamı, ilgili tüm deney koşulları altında sabit bir değere sahip olduğu kabul edilir. Bununla birlikte, deneysel olarak belirlenen bir K değerine milimol/litre veya mikromol/litre gibi bir boyutun eklenmesi yaygın bir uygulamadır .
Büyük bir değer, konukçu ve konuk moleküllerin konukçu-konuk kompleksini oluşturmak için güçlü bir şekilde etkileşime girdiğini gösterir.
Bağlanma sabiti değerlerinin belirlenmesi
Basit ev sahibi-misafir karmaşıklığı
Konak ve konuk moleküller tek bir kompleks oluşturmak üzere birleştiğinde denge şu şekilde temsil edilir:
ve denge sabiti K, şu şekilde tanımlanır:
burada [X], X kimyasal türünün konsantrasyonunu belirtir (tüm aktivite katsayılarının sayısal değerlerinin 1 olduğu varsayılır). Herhangi bir veri noktasında kütle dengesi denklemleri,
burada ve burada konak ve misafirin toplam konsantrasyonları, örneğin [G]'de tek bir ikinci dereceden denkleme indirgenebilir ve böylece verilen herhangi bir K değeri için analitik olarak çözülebilir. [H] ve [HG] konsantrasyonları sonra türetilmiştir.
Hesaplamadaki bir sonraki adım, gözlemlenen miktara karşılık gelen bir miktarın değerini hesaplamaktır . Daha sonra, tüm veri noktaları üzerindeki U karelerinin toplamı, np, şu şekilde tanımlanabilir:
ve bu, kararlılık sabit değeri K ve HG türünün kimyasal kayması (nmr verileri) veya onun molar emiciliği (uv/vis verileri) gibi bir parametreye göre en aza indirilebilir. Minimizasyon, yerleşik SOLVER yardımcı programı kullanılarak EXCEL gibi bir elektronik tablo uygulamasında gerçekleştirilebilir .
Bu prosedür, yalnızca 1:1 eklentisinin oluşan tek karmaşık tür olduğu kesin olduğunda kullanılmalıdır. Bu iddianın geçerliliğinin basit bir kontrolü, artıkların rastgele bir dağılım göstermesi gerektiğidir ; aksi takdirde, aşağıdaki bölümdeki yöntemler kullanılarak ikinci bir türün oluşumu düşünülmelidir.
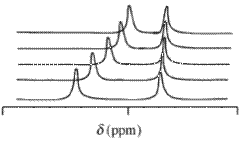
Nükleer manyetik rezonans (NMR) verileri
İle nükleer manyetik rezonans (NMR) spektrumları, gözlemlenen kimyasal yer değiştirme değeri, Í belirli bir atomundan oluşan bir reaktif molekül ve bu reaktif bir veya daha fazla kompleksler içerdiği, bu kimyasal türlerin her kaymaların konsantrasyona ağırlıklı ortalaması olacaktır. NMR zaman ölçeğinde kimyasal değişimin hızlı olduğu varsayılır. mol kesri terimleri ,
kimyasal kayma olduğunu i çekirdek içerir ve inci kimyasal türlerin (konsantrasyon / mol fraksiyonu olan C bir konsantrasyon / mol dm-olduğunu -3 bu türün). Bu ifade, Beer yasası ile aynı matematiksel forma sahiptir . Kimyasal kayma değerleri, absorbansın birden fazla dalga boyunda ölçülebilmesine benzer bir şekilde, birden fazla çekirdek için elde edilebilir. Bu bağlamda kullanılabilecek tipik izotoplardır 1 H, 13 ° C ve 31 bir kullanımı olağandır S. dötoryumlanmış ölçülürken çözücü 1 H kimyasal kayma değerleri.
Absorbans verileri
Beer-Lambert yasasına göre, her türün absorbansının o türün konsantrasyonuyla orantılı olduğu varsayılır .
λ bir dalga boyu olduğu, bir solüsyon ihtiva küvetin optik yol uzunluğu N bileşikleri ( kromoforlar ), (aynı zamanda yok olma katsayısı olarak da bilinir), mol absorbanstır ı dalga boyu λ, th kimyasal türler c ben onun konsantrasyonu. Konsantrasyonlar yukarıdaki gibi hesaplandığında ve çeşitli konukçu ve konuk konsantrasyonlarına sahip numuneler için absorbans ölçüldüğünde, Beer-Lambert yasası, belirli bir dalga boyunda lineer en küçük kareler ile çözülebilen bir dizi denklem sağlar. o dalga boyunda bilinmeyen sönme katsayısı değerleri için işlem.
Floresan verileri
Bu tür verilerin işlenmesi, absorbans verilerinin işlenmesine benzer. Aslında, floresan yoğunluğu ile türlerin konsantrasyonları arasındaki ilişkiyi tanımlayan denklem çok benzerdir.
birim konsantrasyonda i türün floresan yoğunluğu nerede .
kalorimetri
Konuk içeren bir çözeltiye konukçu çözeltiden bir kısım eklendiğinde ortaya çıkan ısı, her reaksiyondan gelen katkıların toplamıdır.
burada veri noktası (tüm yabancı ısı katkıları için düzeltilmiştir) ölçülü bir ısı değişim değeri j , ısı miktarı absorbe edilir ya da 1 mol zaman yayılan olan I inci reaksiyon ürünü oluşturulur ve mol sayısına gerçek değişim o ürün o veri noktasında. denge sabitlerinin verilen değerleri ile kütle-denge denklemlerinin çözülmesiyle hesaplanır. Denge sabiti değerleri biliniyorsa, standart entalpi değişimi doğrusal bir en küçük kareler işlemiyle hesaplanabilir, aksi takdirde doğrusal olmayan bir veri uydurma yöntemi kullanılmalıdır.
İzotermal titrasyon kalorimetrisi , hem bir denge sabitinin hem de karşılık gelen standart reaksiyon entalpisinin değerlerini belirlemek için yaygın olarak kullanılır. ITC cihazlarının üreticileri, bu miktarların deneysel veri değerlerinden elde edilebileceği bazı yazılımlar sağlar.
Genel kompleksleşme reaksiyonu
Bir konakçı, H ve bir konuk G içeren her denge için
denge sabiti, , olarak tanımlanır
Serbest konsantrasyonların değerleri ve kütle dengesi denklemlerinin stabilite sabitleri için bilinen veya tahmin edilen değerlerle çözülmesiyle elde edilir.
Daha sonra, her bir karmaşık türün konsantrasyonları da olarak hesaplanabilir . Bir türün konsantrasyonu ile ölçülen miktar arasındaki ilişki, yukarıdaki her bölümde belirtildiği gibi, ölçüm tekniğine özeldir. Bu ilişki kullanılarak, parametre seti, kararlılık sabit değerleri ve molar absorptivite veya belirli kimyasal kaymalar gibi özelliklerin değerleri, doğrusal olmayan en küçük kareler arıtma işlemi ile rafine edilebilir . Teorinin daha ayrıntılı bir açıklaması için bkz . Denge sabitlerinin belirlenmesi . Bazı özel bilgisayar programları Uygulamalar'da listelenmiştir .
Standart entalpi ve entropi değişim değerlerinin belirlenmesi
İlk olarak, bir çözümün , tek kompleks HG ile dengede belirli miktarlarda bir konakçı ( H) ve bir konuk ( G) içerdiği sistemi düşünün .
Şimdi, dengedeki bir konukçu ve konuk karışımına az miktarda konuk eklendiğini varsayalım. Daha sonra yeni bir denge kurulacak ve bir miktar ısı, Q gelişecektir. Bu miktar ölçüldüğünde ve araçsal faktörler için düzeltildiğinde , çözeltide mevcut olan kompleks HG miktarındaki değişiklik ile ilgilidir .
Δ burada H ⊖ olan standart oluşum entalpi olup, kompleks, 1 mol oluşumu için entalpisi HG ve türlerin mol sayısına değişimdir HG çözelti içinde.
Denge sabitinin değeri biliniyorsa, miktar , toplamadan önce ve sonra kütle dengesi denklemleri çözülerek hesaplanabilir (yukarıdaki #Basit konak-konuk kompleksine bakın ). Daha sonra, Δ H ⊖ değeri, Q'nun bir dizi deneysel değeri ile doğrusal en küçük kareler uydurma yöntemi kullanılarak elde edilebilir .
K değeri bilinmiyorsa, iki parametreyi elde etmek için doğrusal olmayan bir en küçük kareler iyileştirmesi yapılmalıdır ve . Veriler bir İzotermal titrasyon kalorimetresi kullanılarak elde edildiğinde , hesaplamalar için gerekli yazılım cihaz üreticisi tarafından sağlanır.
Not: standart entalpi değişimini hesaplamak için van't Hoff denkleminin kullanılması, bu yöntem kullanılarak elde edilen değerin aşırı hataya maruz kalması muhtemel olduğundan kullanımdan kaldırılmıştır .
Genel olarak, ne zaman m kompleksleri geliştirilen ısı oluşur k "titrasyon" alanına inci, bir reaksiyon ürününün konsantrasyonunda bir değişiklikten kaynaklanan katkıların toplamıdır.
Var 2m belirlenecek parametresi, standart bir entalpi değişimi ve her bir reaksiyon ürününün oluşturulması için bir denge sabitidir. ITC cihaz üreticileri, birden fazla parametre değerinin hesaplanabileceği birkaç özel yazılım ürünü sağlar. HypΔH gibi genel durum için bilgisayar programları . Affinimetre ITC de mevcuttur.
Her standart entalpi değişiminin ve denge sabitinin değerleri belirlendiğinde, karşılık gelen standart entropi değişiminin değeri ifadeden türetilebilir.
verilen sıcaklıkta, T .
deneysel teknikler
Nükleer manyetik rezonans
Nükleer manyetik rezonans (NMR), analitik kimyadaki en güçlü spektroskopik tekniklerden biridir. Agregalar, iyon çifti veya kapsüllenmiş sistemler şeklinde var olan çeşitli komplekslerin yapılarını aydınlatmak için konak-konuk komplekslerinin çalışmaları için önemli bir araçtır . Adından da anlaşılacağı gibi, NMR , kimyasal kaymalarını ölçerek moleküllerdeki (en yaygın olarak proton ) farklı çekirdekleri tanımlar . İki molekülün bağlanma aktivitesi, elektronik ortamlarında önemli bir değişikliğe neden olur. Bu, NMR spektrumundaki sinyallerde bir kaymaya yol açar ve bu temel ilke, konukçu-misafir kimyası fenomenini incelemek için kullanılır. Konak-misafir bağlanması için itici güçler, hidrojen bağı ve pi-pi etkileşimi gibi moleküller arasındaki çeşitli ikincil etkileşimlerdir . Bu nedenle, NMR aynı zamanda bir konak-misafir kompleksinde bu etkileşimlerin varlığını belirlemek için önemli bir teknik olarak hizmet eder.
Önceki NMR çalışmaları, farklı konukların ev sahiplerine bağlanması hakkında faydalı bilgiler verdi. Fox et al. piridin molekülleri ve poli(amido amin (PAMAM) dendrimer arasındaki hidrojen-bağ etkileşimlerini amin ve amid gruplarının kimyasal kaymasına dayanarak hesapladılar.Benzer bir çalışmada, Xu ve diğerleri, karboksilat bazlı G4 PAMAM dendrimerini titre etti ( konak) çeşitli amin bazlı ilaçlarla (misafirler) ve dendrimerin kimyasal kaymalarını izlediler.2D- NOESY NMR teknikleri ile birlikte , ilaçların dendrimerler üzerindeki konumunu ve işlevselliğin etkisini tam olarak belirleyebildiler. Katyonik ilaç moleküllerinin anyonik dendrimerlerin yüzeyine elektrostatik etkileşimlerle bağlandığını , oysa anyonik bir ilacın dendrimerlerin hem çekirdeğinde hem de yüzeyinde lokalize olduğunu ve kuvvetin güçlü olduğunu gösteren kesin kanıtlar buldular. Bu etkileşimlerin çoğu moleküllerin pKa değerlerine bağlıdır .
Farklı bir çalışmada Sun ve ark. cucurbituril ile rutenyum trisbipiridil-viologen moleküllerinin konukçu-misafir kimyasını inceledi . Piridin protonlarının viologen üzerindeki kimyasal kaymalarındaki değişimi izlerken , 1:1 kompleksleri için bağlanma modlarının farklı cucurbituril molekülleri için tamamen farklı olduğunu buldular.
Ana bilgisayar ve konuk arasındaki bağlamayı analiz ederken akılda tutulması gereken önemli bir faktör, bağlama olayının süresine kıyasla veri toplama için geçen süredir. Çoğu durumda, bağlanma olayları, veri toplamanın zaman ölçeğinden çok daha hızlıdır, bu durumda çıktı, tek tek moleküller ve kompleks için ortalama bir sinyaldir. NMR zaman ölçeği, bağlanma reaksiyonunun hızlı olduğu belirli durumlarda tekniğin doğruluğunu sınırlayan milisaniyeler düzeyindedir.
Ultraviyole-görünür spektroskopi
Ultraviyole-görünür spektroskopi , çeşitli moleküllerin bağlanma aktivitesini incelemenin en eski ve en hızlı yöntemlerinden biridir. UV ışığının absorpsiyonu, pikosaniyelik bir zaman ölçeğinde gerçekleşir , bu nedenle türlerden gelen bireysel sinyaller gözlemlenebilir. Aynı zamanda, absorpsiyon yoğunluğu, türlerin konsantrasyonu ile doğrudan ilişkilidir, bu da ilişki sabitinin kolay hesaplanmasını sağlar. En yaygın olarak, ya konakçı ya da konuk UV ışığına karşı şeffaftır, diğer molekül ise UV'ye duyarlıdır. UV'ye duyarlı moleküllerin konsantrasyonundaki değişiklik bu şekilde izlenir ve Benesi-Hildebrand yöntemi kullanılarak düz bir çizgiye uydurulur , buradan ilişki sabiti doğrudan hesaplanabilir.
Benesi-Hilderbrand yöntemi konakçı ve konuk arasında 1:1 stokiyometri varsaydığından, komplekslerin stokiyometrisi hakkında ek bilgi de elde edilir. Veriler, yalnızca karmaşık oluşumun da benzer bir 1:1 stokiyometriyi izlemesi durumunda düz bir çizgi verecektir. Benzer bir hesaplamanın yakın tarihli bir örneği Sun ve diğerleri tarafından yapıldı; burada rutenyum trisbipiridil-viologen moleküllerini kabakgil[7]urillerle titre ettiler ve kabakgil moleküllerinin belirli bir dalga boyunda toplam konsantrasyonunun bir fonksiyonu olarak göreceli absorbansını çizdiler. Veriler, bağlama sabiti olan 1:1 bağlama modeline güzel bir şekilde uydu .
Bir uzantı olarak, ev sahibi ve konuk arasındaki bağlama olaylarının kinetiğini anlamak için verileri farklı stokiyometrilere sığdırabilirsiniz. baryum içeren taç eter köprülü kiral heterotrinükleer salen Zn(II) kompleksi (konakçı) ile çeşitli konuk imidazoller ve amino asit metil esterleri arasındaki kompleksleşme reaksiyonunun sırasını elde etmek için geleneksel Benesi-Hilderbrand planını hafifçe değiştirmek için bu sonucu kullandı , diğer parametrelerle birlikte. 368 nm'de pi-pi* geçiş bandının absorbansındaki değişiklikleri izlerken, değişen miktarlarda imidazoller ve metil esterlerle çinko kompleksinin sabit bir konsantrasyonunu titre ettiler. Veriler, konuk-ev sahibi oranının komplekste 2 olduğu bir modele uyar. Ayrıca bu deneyleri çeşitli sıcaklıklarda gerçekleştirerek van't Hoff denklemini kullanarak çeşitli termodinamik parametreleri hesaplamalarını sağladılar .
İzotermal titrasyon kalorimetrisi
Spektroskopik teknikler hakkında bilgi vermek bağlama sabiti ve Gibbs serbest enerjisi , . ve gibi termodinamik parametrelerin tamamını elde etmek için van 't Hoff denklemini kullanan bir van 't Hoff analizi gerekli olacaktır. Bununla birlikte, kalorimetrik tekniklerdeki son gelişmeler, tek bir deneyde ölçüm yapılmasına ve böylece denklem kullanılarak tüm termodinamik parametrelerin belirlenmesine olanak tanır:
deneyin izotermal koşullarda yapılması şartıyla; bu nedenle izotermal kalorimetri adı. Prosedür konvansiyonel bir titrasyon prosedürüne benzerdir, burada konakçı sıralı olarak konuğa eklenir ve absorbe edilen veya yayılan ısı boş bir solüsyona kıyasla ölçülür. Yayılan toplam ısı, Q , ilişki sabitine ve denkleme karşılık gelir:
Hangisi basitleştirilebilir
Nereye
- = Konağın başlangıç molar konsantrasyonu
- = Konuğun molar konsantrasyonu
- = geminin hacmi
Yukarıdaki denklem, ve ve ardından ve o belirli reaksiyon için değerini elde etmek için doğrusal olmayan regresyon analizi ile çözülebilir . İzotermal titrasyon kalorimetrisinin diğer yaygın olarak kullanılan tekniklere göre avantajları, termodinamik parametrelerin tamamını vermenin yanı sıra, daha genel olması ve çok çeşitli moleküller için uygun olmasıdır. Isı sinyali bağlanma reaksiyonlarının evrensel bir özelliği olduğundan, bağlanma sürecini izlemek için kromoforlu veya UV-görünür fonksiyonel gruplara sahip bileşiklere sahip olmak gerekli değildir. Aynı zamanda, sinyal-gürültü oranı oldukça uygundur, bu da çok seyreltik koşullar altında bile bağlanma sabitlerinin daha doğru belirlenmesine izin verir. Bu tekniğin kullanımının yakın tarihli bir örneği, Escherichia coli'yi çevreleyen protein zarının , çeşitli zar mimetik ortamlarında ilaçlarda kullanılan lipofilik katyonlara bağlanma afinitesini incelemek içindi . Yukarıdaki çalışmanın motivasyonu, bu zarların bakterileri , anti-bakteriyel etkilere sahip olan kuaterner amonyum katyonuna dayalı çoğu bileşiğe karşı dirençli hale getirmesidir . Böylece bağlanma fenomeninin anlaşılması, E. coli için etkili antibiyotiklerin tasarlanmasını mümkün kılacaktır . Araştırmacılar, bağlanma reaksiyonunun tamamlanmasına izin vermek için protein üzerinde büyük miktarda ligand bulundurdular. Araştırmacılar, yukarıdaki denklemleri kullanarak farklı ortamlardaki her bir ilaç için , , ve hesaplamaya başladılar . Veriler, ilacın membran ile bağlanma stokiyometrisinin, mikromolar değeri ile 1:1 olduğunu gösterdi . , ve negatif değerleri , işlemin her ilaç için 8-12 kcal/mol değerinde entalpi tarafından yönlendirildiğini gösterdi.
Uygulamalar
Raman spektroskopisi
Raman spektroskopisi , üzerine monokromatik ışık geldiğinde Raman saçılması etkisi gösteren moleküllerin incelenmesinde kullanılan spektroskopik bir tekniktir . Bir Raman sinyali almak için temel gereksinim, gelen ışığın kimyasal türlerde temel durumundan sanal bir enerji durumuna elektronik bir geçiş meydana getirmesidir, bu da temel duruma geri döndüğünde bir foton yayacaktır . Emilen ve yayılan foton arasındaki enerji farkı, elektronik ortamına bağlı olarak her kimyasal tür için benzersizdir. Bu nedenle, moleküller arasındaki bağlanma neredeyse her zaman elektronik ortamlarında bir değişiklikle sonuçlandığından, teknik çeşitli bağlanma olaylarının incelenmesi için önemli bir araç olarak hizmet eder. Bununla birlikte, Raman spektroskopisini benzersiz bir teknik yapan şey, yalnızca molekülün polarizasyonundaki bir değişikliğin eşlik ettiği geçişlerin Raman aktif olmasıdır. Raman spektrumlarından elde edilen yapısal bilgi, bireysel konak ve konuk moleküllere kıyasla kompleksin elektronik konfigürasyonu hakkında çok özel bilgiler verir.
Çözelti fazı Raman spektroskopisi genellikle zayıf saçılma kesitiyle sonuçlanır. Bu nedenle, yüzey geliştirilmiş Raman spektroskopisi ve rezonans Raman spektroskopisi gibi Raman sinyallerini geliştirmek için son gelişmeler yapılmıştır . Bu tür teknikler, analit-reseptör bağlanma olaylarını nicelleştirmek için ek bir amaca hizmet eder, konak-konuk kompleksleşmesi fenomeninin gerçekte meydana geldikleri yerde, yani çözeltilerde daha ayrıntılı bir resmini verir. Yakın tarihli bir buluşta, Flood ve ark. SERS'in yanı sıra Raman spektroskopisini kullanarak tetrathiafulvalen (TTF) ve siklobis(paraquat-p-fenilen)' in bağlanma gücünü belirledi . Bu alandaki önceki çalışmalar, birleşme kuvvetlerinin nicel ölçümlerinden ziyade, oluşan kompleksin yapısı ve bağlanması hakkında bilgi sağlamayı amaçlıyordu. Araştırmacılar, 1 mM kadar düşük konsantrasyonlara sahip çözeltilerden algılanabilir sinyaller alabilmek için Rezonans Raman spektroskopisini kullanmak zorunda kaldılar. Özellikle, foto-uyarılmış durumdaki kompleksin geometrisi ile Raman bantlarının yoğunluğunu ilişkilendirdiler. Ultraviyole-görünür spektroskopiye dayalı titrasyona benzer şekilde, bağlanma sabitini "Raman titrasyonu" ile hesapladılar ve bağlanma eğrilerini 1:1 modellere uyarlayarak -5,7±0,6 kcal/mol verdi. Çalışma şimdi, çözümlerde yük transfer komplekslerini içeren benzer çalışmalar için bir temel sağlıyor.
işbirliği
İşbirliği, bir ligandın birden fazla bağlanma bölgesi olan bir reseptöre bağlanması ve ligandın, gelen ligandlar için afinitede bir azalmaya veya artışa neden olması olarak tanımlanır. Sonraki ligandların bağlanmasında bir artış varsa, pozitif işbirliği olarak kabul edilir. Bağlanmada bir azalma gözlemlenirse, bu olumsuz bir işbirliğidir. Pozitif ve negatif işbirliği örnekleri sırasıyla hemoglobin ve aspartat reseptörüdür.
Son yıllarda, pozitif veya negatif işbirliğini ayırt eden matematiksel parametreleri tanımlamak için işbirliğinin termodinamik özellikleri incelenmiştir. Geleneksel Gibbs serbest enerji denklemi şunları belirtir: . Bununla birlikte, bir konuk-konuk sisteminde işbirliğini ölçmek için bağlanma enerjisinin dikkate alınması gerekir. Sağdaki şema, A'nın bağlanmasını, B'nin bağlanmasını, A–B'nin pozitif ortak bağlanmasını ve son olarak, A–B'nin negatif ortak bağlanmasını göstermektedir. Bu nedenle, Gibbs serbest enerji denkleminin alternatif bir formu şöyle olacaktır:
nerede:
- = A bağının serbest enerjisi
- = B bağlamanın serbest enerjisi
- = bağlı A ve B için bağlanmanın serbest enerjisi
- = bağlanmanın serbest enerjilerinin toplamı
O takdirde düşünüldüğünde daha toplamından daha ve bu olumlu kooperatif. Daha az ise, olumsuz işbirlikçidir. Konak-misafir kimyası, reseptör-lingand etkileşimleri ile sınırlı değildir. İyon eşleştirme sistemlerinde de gösterilmiştir. Son yıllarda, bu tür etkileşimler, sentetik organometalik konakçıların ve organik konuk moleküllerin kullanıldığı sulu bir ortamda incelenmiştir. Örneğin, bakır (konakçı) içeren poli-katyonik bir reseptör, tetrakarboksilatlar, trikarballat, aspartat ve asetat (misafir) gibi moleküllerle koordine edilir. Bu çalışma , sistemin negatif işbirliğine yol açan bağlanma enerjisini entalpiden ziyade entropinin belirlediğini göstermektedir . Entropideki büyük değişiklik, ligandı ve reseptörü çevreleyen çözücü moleküllerinin yer değiştirmesinden kaynaklanır. Çoklu asetatlar reseptöre bağlandığında, çevreye bir tetrakarboksilattan daha fazla su molekülü bırakır. Bu, sistemin olumsuz bir şekilde işbirliği yaptığını ima eden serbest enerjide bir azalmaya yol açtı. Benzer bir çalışmada, guanidinyum ve Cu(II) ve polikarboksilat konukları kullanılarak, pozitif işbirliğinin büyük ölçüde entalpi tarafından belirlendiği gösterilmiştir. Termodinamik çalışmalara ek olarak, konukçu-misafir kimyasının biyolojik uygulamaları da vardır.
süperiletkenlik
Düşük sıcaklıklarda ve yüksek basınçlarda bizmutun bir konukçu-konuk yapısı sergilediği bulunmuştur. Bu, şaşırtıcı bir şekilde güçlü kuplaj süperiletkenliğine yol açar.
Biyolojik uygulama
İlaç dağıtım sistemlerindeki dendrimerler, çeşitli konak-konuk etkileşimlerinin bir örneğidir. Konak ve konuk, dendrimer ve ilaç arasındaki etkileşim sırasıyla hidrofobik veya kovalent olabilir. Ev sahibi ve konuk arasındaki hidrofobik etkileşim "kapsüllenmiş" olarak kabul edilirken, kovalent etkileşimlerin konjuge olduğu kabul edilir. Dendrimerlerin tıpta kullanımının, ilacın çözünürlüğünü ve biyoyararlanımını artırarak ilaç dağıtımını iyileştirdiği gösterilmiştir. Birlikte, dendrimerler hem hücresel alımı hem de hedefleme yeteneğini artırabilir ve ilaç direncini azaltabilir.
Çeşitli nonsteroidal antiinflamatuar ilaçların (NSAID) çözünürlüğü, PAMAM dendrimerlerinde kapsüllendiğinde artar. Bu çalışma, NSAID çözünürlüğünün artmasının, PAMAM'daki yüzey amin grupları ile NSAID'lerde bulunan karboksil grupları arasındaki elektrostatik etkileşimlerden kaynaklandığını göstermektedir. Çözünürlükteki artışa, ilaçlardaki aromatik gruplar ile dendrimerin iç boşlukları arasındaki hidrofobik etkileşimler katkıda bulunur. Bir ilaç bir dendrimer içinde kapsüllendiğinde, spesifik olmama ve toksisite dahil olmak üzere fiziksel ve fizyolojik özellikleri değişmeden kalır. Bununla birlikte, dendrimer ve ilaç kovalent olarak birbirine bağlandığında, spesifik doku hedefleme ve kontrollü salım oranları için kullanılabilir. Birden fazla ilacın dendrimer yüzeyler üzerinde kovalent konjugasyonu, çözünmezlik sorunu oluşturabilir.
Bu ilke, kanser tedavisi uygulaması için de çalışılmaktadır. Kamptotesin , Metotreksat ve Doksorubisin gibi birkaç grup, kansere karşı kapsüllenmiş ilaçlara sahiptir . Bu araştırmalardan elde edilen sonuçlar, dendrimerlerin suda çözünürlüğü artırdığını, salım hızını yavaşlattığını ve muhtemelen ilaçların sitotoksisitesini kontrol ettiğini göstermiştir. Sisplatin, yukarıda listelenenlerle aynı farmakolojik sonuçlarla sonuçlanan PAMAM dendrimerlerine konjuge edilmiştir, ancak konjugasyon , intravenöz uygulamada katı tümörlerde sisplatinin birikmesine de yardımcı olmuştur .
algılama
Geleneksel olarak, kimyasal algılamaya, bir bağlayıcı aracılığıyla bir reseptöre kovalent olarak bağlı bir gösterge içeren bir sistemle yaklaşılmıştır. Analit bağlandığında, indikatör renk değiştirir veya floresan verir. Bu teknik, gösterge-aralayıcı-alıcı yaklaşımı (ISR) olarak adlandırılır. ISR'nin aksine, gösterge-yer değiştirme testi (IDA), bir reseptör (konak), gösterge ve bir analit (konuk) arasında kovalent olmayan bir etkileşim kullanır. ISR'ye benzer şekilde, IDA ayrıca kolorimetrik (C-IDA) ve floresan (F-IDA) göstergelerini kullanır. Bir IDA tahlilinde, bir reseptör, gösterge ile inkübe edilir. Karışıma analit eklendiğinde indikatör ortama salınır. Gösterge bırakıldığında ya renk değiştirir (C-IDA) ya da floresan verir (F-IDA).
IDA, geleneksel ISR kimyasal algılama yaklaşımına göre çeşitli avantajlar sunar. İlk olarak, indikatörün reseptöre kovalent olarak bağlanmasını gerektirmez. İkinci olarak kovalent bağ olmadığı için aynı reseptör ile çeşitli indikatörler kullanılabilir. Son olarak, tahlilin kullanılabileceği ortam çeşitlidir.
C-IDA gibi kimyasal algılama tekniklerinin biyolojik etkileri vardır. Örneğin protamin , kardiyopulmoner cerrahiden sonra rutin olarak uygulanan bir pıhtılaştırıcıdır ve herapinin anti-pıhtılaştırıcı etkisine karşı hareket eder. Plazma numunelerinde protamini ölçmek için kolorimetrik bir yer değiştirme testi kullanılır. Azure A boyası bağlanmadığında mavidir, ancak herapine bağlandığında mor renk gösterir. Azure A ve heparin arasındaki bağlanma zayıf ve tersine çevrilebilir. Bu, protaminin Azure A'nın yerini almasına izin verir. Boya serbest bırakıldığında mor bir renk gösterir. Boyanın yer değiştirme derecesi, plazmadaki protamin miktarı ile orantılıdır.
F-IDA faaliyetlerini izlemek için Kwalczykowski ve çalışma arkadaşları tarafından kullanılmış olan Helikazın içinde E.coli . Bu çalışmada indikatör olarak tiyazol portakal kullanmışlardır. Helikaz, ssDNA yapmak için dsDNA'yı çözer. Tiyazol portakalının floresan yoğunluğu, dsDNA'ya ssDNA'dan daha büyük bir afiniteye sahiptir ve floresan yoğunluğu, dsDNA'ya bağlandığında, bağlı olmadığı duruma göre artar.
konformasyonel anahtarlama
Bir kristalin katı madde geleneksel olarak atom bileşenlerinin hareketleri de titreşim denge sınırlıdır statik bir varlık olarak incelendi. Grafitin elmasa dönüşümünde görüldüğü gibi, fiziksel veya kimyasal basınç altında katıdan katıya dönüşüm meydana gelebilir. Son zamanlarda, bir kristal düzenlemesinden diğerine dönüşümün işbirlikçi bir şekilde gerçekleştiği öne sürülmüştür. Bu çalışmaların çoğu, organik veya metal-organik bir çerçeveyi incelemeye odaklanmıştır. Makromoleküler kristal dönüşüm çalışmalarına ek olarak, organik çözücülerin varlığında konformasyonlarını değiştirebilen tek kristalli moleküller üzerine çalışmalar da vardır. Bir organometalik kompleksin, çözücü buharlarına maruz kalıp kalmadığına bağlı olarak çeşitli yönlere dönüştüğü gösterilmiştir.
Çevresel uygulamalar
Tehlikeli maddelerin ortamdan uzaklaştırılması için konukçu konuk sistemleri kullanılmıştır. Çeşitli kimyasal konukları yakalamak için farklı boyutlarda ve farklı şekillerde yapılabilirler. Bir uygulama, p-tert-butycalix[4]aren'in bir sezyum iyonunu yakalama yeteneğidir. Sezyum-137 radyoaktiftir ve nükleer atıklardan verimli bir şekilde çıkarılmasına ihtiyaç vardır. Ev sahibi-misafir kimyası ayrıca kanserojen aromatik aminleri ve bunların N-nitrozo türevlerini sudan uzaklaştırmak için kullanılmıştır. Bu atık maddeler birçok endüstriyel proseste kullanılır ve pestisitler, ilaçlar ve kozmetikler gibi çeşitli ürünlerde bulunur.



![{\displaystyle K_{a}^{\ominus }={\frac {\{HG\}}{\{H\}\{G\}}}={\frac {[HG]}{[H][ G]}}\times \Gama }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{\görüntüleme stili [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)
![{\görüntüleme stili [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{\görüntüleme stili [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)

![{\displaystyle K_{a}={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{\displaystyle K={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{\displaystyle T_{H}=[H]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{\displaystyle T_{G}=[G]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{\displaystyle [H]=T_{H}-T_{G}+[G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{\displaystyle [HG]=K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)





















![{\displaystyle \beta _{pq}={\frac {[H_{p}G_{q}]}{[H]^{p}[G]^{q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{\displaystyle T_{H}=[H]+\sum p\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{\displaystyle T_{G}=[G]+\sum q\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{\displaystyle [H_{p}G_{q}]=\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)














![{\displaystyle Q={V\Delta H_{0}[HG]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)
![{\displaystyle Q={\frac {V\Delta H_{0}K_{a}[H_{0}][G]}{1+K_{a}[G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{\görüntüleme stili [H_{0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)













