Döngüsel nükleotid kapılı iyon kanalı - Cyclic nucleotide–gated ion channel
Siklik nükleotid-kapılı iyon kanalı veya CNG kanalları olan iyon kanalları bağlanmasına yanıt olarak bir işlevi olduğunu siklik nükleotid . CNG kanalları, çeşitli doku ve hücre tiplerinin zarlarında bulunan seçici olmayan katyon kanallarıdır ve hücresel gelişim kadar duyusal iletimde de önemlidir . İşlevleri, siklik nükleotidlerin (cGMP ve cAMP) bağlanması ile bir depolarizasyon veya bir hiperpolarizasyon olayının bir kombinasyonunun sonucu olabilir . Başlangıçta gözün retinasını oluşturan hücrelerde keşfedilen CNG kanalları, hem hayvan hem de bitki krallığında birçok farklı hücre tipinde bulunmuştur . CNG kanalları , işlevlerinde kritik rol oynayan çeşitli alt birimler ve etki alanları ile çok karmaşık bir yapıya sahiptir . CNG kanalları, görme ve koku alma gibi çeşitli duyu yollarının yanı sıra hormon salınımı ve kemotaksi gibi diğer temel hücresel işlevlerde önemlidir . Bakteri fizyolojisindeki kesin rolleri bilinmemekle birlikte , birçok spirochaeta da dahil olmak üzere prokaryotlarda CNG kanallarının da var olduğu bulunmuştur .
keşif
CNG kanallarının keşfi, retinal fotoreseptörlerdeki yanıtların aracılığından sorumlu hücre içi habercilerin keşfi ile ilgilidir . Keşiflerinden önce, siklik nükleotitlerin fosforilasyonda rol oynadığı düşünülüyordu . 1985 yılında, cGMP'nin , kurbağaların ışığa uyarlanmış retinalarını inceleyerek , çubuk iyon kanallarının ışığa bağımlı tepkisini doğrudan etkinleştirebildiği keşfedildi . CNG kanalları ayrıca bulundu koni Fotoreseptörlerin, hassas kemoterapiye kirpikler ait koku duyu nöronları ve epifiz bezi . Saflaştırılmış proteinlerden amino asitlerin tanımlanmasından sonra, CNG kanallarının klonlanması ve fonksiyonel ekspresyonu gerçekleştirildi. Moleküler klonlama , diğer birçok dokuda benzer kanalların keşfedilmesine izin verdi. 2000 yılında bilim adamları, kanalın yeni bir alt birimi olan CNG6'yı bulmak için fare retinası ve moleküler klonlama kullanarak çalışmalar yaptılar.
İşlev
CNG kanalları önemli işlevleri sinyal iletiminde de retina fotoreseptörleri ve koku verici nöronlar . Doğrudan siklik nükleotitler tarafından aktive edilirler ve her kanalı aktive etmek için yaklaşık 4 siklik nükleotit gerekir. CNG kanalları seçici değildir ve zarında CNG kanalları ifade eden bir hücrenin içine veya dışına birçok alkali iyonunun akmasına izin verir . Bu iyon akışı, depolarizasyon veya hiperpolarizasyona neden olabilir . CNG kanalları, yalnızca cAMP veya cGMP tarafından veya bazen her iki cNMP'nin bir kombinasyonu ile etkinleştirilebilir ve bazı kanallar diğerlerinden daha seçicidir. Bu kanalların aktivitesi çok az voltaj bağımlılığı gösterse de, yine de voltaja bağlı kanallar olarak kabul edilirler. Kalsiyum , kalmodulin ve fosforilasyon , CNG kanallarının açılmasını modüle eder.
CNG kanallarının ana rolü, çeşitli dokularda duyusal iletimdir . Birçok çalışma, çubuk ve koni fotoreseptörlerinde CNG kanallarını göstermiştir ve bunlar ayrıca beyin , kalp , böbrekler ve gonadlarda da bulunmuştur .
CNG kanal homologları içinde Caenorhabditis elegans , Drosophila melanogaster ve Limulus Polyphemus bilinmeyen işlevlere sahiptir. Çalışmalar, C. elegans'taki homologların kemosensasyonda işlevleri olabileceğini göstermiştir .
CNG kanallarında mutasyonlar olduğunda renk körlüğü ve retina dejenerasyonu ortaya çıkar. Özellikle A ve B alt birimlerindeki mutasyonlar , tam ve eksik akromatopsi ile sonuçlanır .
Yapı
Bir CNG kanalı, merkezi bir gözenek etrafındaki dört alt birimden oluşur . Her protein alt birimi 6 transmembran segmenti (S1-S6), bir P halkası , hücre içi amino terminal bölgesi ve karboksi terminal bölgesinden oluşur. İyon iletiminde rol oynayan gözenek etrafındaki P-loop ve S6 segmentleri. Karboksi terminalinde bir siklik nükleotid bağlama alanı (CNBD) ve S6 segmentine bağlantı bölgesi vardır. Amino terminalinde CNDB sonrası bir bölge vardır .
Alfa alt birimleri
Döngüsel nükleotid kapılı kanal alfa alt birimleri şunları içerir:
- Döngüsel nükleotid kapılı kanal alfa 1
- Döngüsel nükleotid kapılı kanal alfa 2
- Döngüsel nükleotid kapılı kanal alfa 3
- Döngüsel nükleotid kapılı kanal alfa 4
Beta alt birimleri
Döngüsel nükleotid kapılı kanal beta alt birimleri şunları içerir:
Gözenek
Gözeneğin yapısı, P-döngüleri içeren diğer iyon kanallarına benzer. P-döngüsü , hücre dışı taraftan gözenek zarına girer ve hücre içi tarafa çıkar . P halkası bir alfa sarmalı olarak girer ve sarılmamış bir iplik olarak bulunur. İç zarı kaplayan sarmallar kanalı sıralar . Bunlar ayrıca girişi simgeleyen 6 sarmallı bir demet oluşturur. Gözenekleri açmak için içteki 6 sarmal demetinde konformasyonel bir değişiklik meydana gelmelidir.
Döngüsel nükleotid bağlama alanı
Bir Siklik nükleotid bağlayıcı bulunan bir hücre içi alanı olan C-terminali bölgesi ve diğer siklik nükleotid-bağlayıcı proteinlere benzer dizisine sahiptir. Alanın bir β kıvrımlı levha ve iki α sarmaldan oluştuğuna inanılmaktadır . β kıvrımlı tabaka, sekiz antiparalel iplikten oluşur. α sarmalları B ve C sarmalları olarak adlandırılır. Bir ligand başlangıçta β kıvrımlı tabakaya bağlanır ve allosterik düzenleme yoluyla β kıvrımlı tabakaya doğru bir α sarmalının hareketine neden olur. α-sarmal kapalı kanallarda esnektir. Bir CNGA1 alt biriminin bir a sarmalı, başka bir a sarmalına çok yakın olduğunda, alt birimler arası disülfid bağları oluştururlar . Bu, esas olarak kapalı kanallarda meydana gelir ve α sarmalının β kıvrımlı tabakaya doğru hareketini engeller. Bir ligand β kıvrımlı tabakaya bağlandığında, bu bağlı siklik nükleotit, a sarmalının her bir alt birimdeki β kıvrımlı tabakaya doğru hareketini stabilize ederek a sarmallarını birbirinden uzaklaştırır.
Klinker
C-bağlayıcı, CNBD'yi S6 segmentine bağlayan bir bölgedir. C-bağlayıcı bölgesi, kanal alt birimleri arasındaki temasa katkıda bulunur ve ayrıca tetramerlerin oluşturulması olan tetramerizasyonu destekler . CNG kanallarının modülasyonunda rol oynayan birçok kalıntı vardır. Bu işlemde nikel , çinko , bakır ve magnezyum gibi metaller kullanılır . C-bağlayıcı bölgesi, gözenek açıklığına bağlanan ligandın birleştirilmesinde rol oynar. C bağlayıcı bölgesi , N-terminal bölgeleriyle disülfid bağları oluşturur . Disülfid bağları kanal işlevini değiştirir, bu nedenle büyük olasılıkla üçüncül yapıya yakındırlar . Disülfid bağları , kapalı duruma kıyasla açık durumun serbest enerjisini azaltır . C-bağlayıcı bölgesindeki spesifik sistein kalıntısı C481, bağlanma alanından sadece birkaç amino asit uzakta bulunur . Kapalı durumda C481 reaktif değildir; C481 , kanalın açılması için erişilebilir olması için bir konformasyonel değişikliğe uğramalıdır . Komşu alt birimler ve C481 arasında disülfid bağları oluşur. Aynı zamanda , C-bağlayıcı bölgesinin N-terminalinde iki C481 tortusuna ulaşabilen ve bir C481-C481 bağına kıyasla uygun bir disülfid bağı oluşturan bir C35 sistein tortusu vardır .
S6 bölgesi
Kendiliğinden disülfid bağı oluşumu duruma bağlıdır, bu da sarmal demetindeki konformasyonel değişikliğin kanal geçişine bağlı olduğu anlamına gelir . CNG iyon kanalları kapatıldığında S6 sarmallarının sitoplazmik uçları birbirine çok yakındır. Küçük katyonlar bir açıklıktan geçebilir, bu da geçidin sarmal demetinin ötesinde olduğu ve S6 sarmallarının seçicilik filtresindeki konformasyonel değişikliklerle bağlantılı olduğu anlamına gelir .
P bölgesi
P bölgesi, kanalın merkezi eksenine uzanan S5 ve S6 bölgelerini birbirine bağlayan bir gözenek döngüsü olan bir döngü oluşturur. İyonik özellikler, S5 ve S6 transmembran segmentleri arasındaki halkadaki kalıntılar tarafından belirlenir . P bölgesi, CNG kanallarının gözenek çapını da belirleyen döngüsel nükleotid kapılı iyon kanalının iyon seçiciliğini belirler. P bölgesi, kapalı durumda iyon geçirgenliğini engellediği için bir kanal kapısı işlevi görür. Gözenek, bu bölgedeki küçük konformasyonel değişikliklerle engellenebilir. P bölgesi, açık konformasyonda yapıyı değiştiren bir iyon seçicilik filtresi görevi görür. Açık durumda, dört özdeş alt birim, bir seçicilik filtresi oluşturan tek bir P-döngü bölgesine katkıda bulunur.
CNG kanal ailesi
Omurgalılarda CNG kanalı gen ailesi altı üyeden oluşur. Bu genler, dizi benzerliğine göre CNGA ve CNGB olmak üzere iki alt tipe ayrılır. CNG kanallarını kodlayan ek genler, Caenorhabditis elegans ve Drosophila melanogaster'dan klonlanmıştır . Daha önce çubuk a alt birimi olarak adlandırılan bir CNG kanalı CNGA1'in bir alt birimi, çubuk fotoreseptörlerinde eksprese edildi ve Xenopus oositlerinde veya bir insan embriyonik böbrek hücre hattında ( HEK293 ) harici olarak eksprese edildiğinde cGMP tarafından kapılanan fonksiyonel kanallar üretti . İnsanlarda, mutasyona uğramış CNGA1 genleri , dejeneratif bir körlük şekli olan otozomal resesif bir retinitis pigmentosa formu ile sonuçlanır. Önceden çubuk β alt birimi olarak adlandırılan CNGB1 , çubuk kanalının ikinci bir alt birimidir . CNGA1'den farklı olarak, tek başına ifade edilen CNGB1 alt birimleri, fonksiyonel CNG kanalları üretmez, ancak CNGA1 ve CNGB1 alt birimlerinin birlikte ekspresyonu, yerel kanallarla karşılaştırılabilir modülasyon, geçirgenlik , farmakoloji ve siklik-nükleotit özgüllüğü olan heteromerik kanallar üretir .
CNG kanalları tetramerler oluşturur ve son çalışmalar, doğal çubuk kanallarının üç CNGA1 alt birimi ve bir CNGB1 alt biriminden oluştuğunu göstermektedir. Daha önce koni α alt birimleri olarak adlandırılan CNGA3 alt birimleri, ekspresyonu eksojen olarak gerçekleştiğinde fonksiyonel kanallar oluşturur. Öte yandan, daha önce koni β alt birimi olarak adlandırılan CNGB3 bunu yapmaz. İnsan CNGA3 ve CNGB3'teki mutasyonlar, renk ayrımında tam başarısızlık ile karakterize , nadir, otozomal resesif geçişli kalıtsal ve konjenital bir hastalık olan tam akromatopsi ile ilgilidir .
CNGA2 , daha önce koku α alt birimi olarak adlandırılan CNGA4 transdüksiyonu katılan daha önce koku β alt birimi ve CnGB1b adlandırılan, koku alt-birimi olan koku duyu nöronlarında sinyalleri stoikiometri ve düzenlenmesi bilinmemektedir.
Gelen omurgasızlar , CNG kanalı alt-birimi CNG P1 klonlanmıştır adı D. melanogaster ve ifade edilir anten ve görme sistemi, CNG kanal omurgasız ışık transdüksiyonu ile bağlantılı olabilir dair bir gösterge. D. melanogaster'dan klonlanan CNGL adı verilen ikinci bir varsayılan CNG benzeri alt birimin beyinde eksprese edildiği bulunmuştur. İki CNG kanalı alt birimleri, vergi-2 ve vergi-4, klonlanmıştır C. elegans ve chemosensation, sorumludur thermosensation ve normal akson bazı duyu nöronlarının büyümesinin C. elegans .
bağlama olayı
Ligand, fosfat bağlama kaseti (PBC) ile etkileşimler nedeniyle boşluğun dibine yerleştirilebilir. Bu boşluk, iki ilmekli bir β sarmalı olan β silindiri tarafından oluşturulan CNBD'deki bir bölgeyi ifade eder . Ligand bağlanmasının neden olduğu değişiklikler α sarmallarında (αA, αB ve αC ve PBC sarmalında) meydana gelir. β silindiri bağlama sırasında sadece küçük değişikliklere uğrar. Ligand oturduktan sonra, αB ve αC helisleri kendilerini boşluk üzerinde bir başlık oluşturacak şekilde düzenlerler. Bağlanmanın αA sarmalını nasıl etkilediği hala belirsizdir.
Kooperatif ve kooperatif olmayan aktivasyon
CNG kanalları ve ligand konsantrasyonu arasındaki dik konsantrasyon, en az iki veya üç siklik nükleotidin gerekli olduğunu gösterir. Kanalın kapalıdan açık duruma geçmesi için ikinci ligandın gerekli olduğuna inanılmaktadır. Üçüncü ve dördüncü ligandlar bağlandığında, kanalın açık durumu stabilize olur. Bakterilerde, CNG kanallarının açılması, işbirlikçi olmayan bağlanmanın sonucudur. Farklı ligand konsantrasyonları ile, bu farklı ortamlara uyum sağlamak için işbirlikçi bağlanma ve işbirlikçi olmayan bağlanma ortaya çıkar. Düşük ligand konsantrasyonlarında, bir ligandın işbirliği içinde bağlanması nadirdir, çünkü düşük konsantrasyonlarda işbirliğine dayalı bağlanma, kanal ve ligand arasındaki bağlanmayı zayıflatarak kanal duyarlılığını azaltır.
ligand seçiciliği
Değişen süperfüzyon üzerine eksize iç-dış zar yamalar aktive akımlarının ölçülmesi ile ligand konsantrasyonları, her iki ligand duyarlılık ve seçicilik , endojen ve ekzojen olarak ifade CNG kanalları incelenmiştir. Tüm doğal CNG kanallarının her ikisi de tepki cAMP ve cGMP , ama cGMP daha küçük konsantrasyonlar cAMP daha geçirmek için gerekli olan ve kanal açmak. CNG kanalları, çubuklarda ve konilerde cGMP ve cAMP arasında keskin bir şekilde seçicidir, oysa OSN'lerde kanallar her iki liganda da eşit derecede iyi yanıt verir. OSN'lerde bulunan CNG kanalları, hem cGMP'ye hem de cAMP'ye fotoreseptör CNG kanallarından çok daha duyarlıdır. Doz tepki ilişkileri çalışmaları, kanal aktivasyonunun büyük ölçüde cGMP konsantrasyonuna bağlı olduğunu göstermiştir; birkaç cGMP molekülü kanala işbirlikçi bir şekilde bağlanır. Her alt birim tek bir cNMP bağlama bölgesi içerdiğinden ve homomerik ve heteromerik kanallar büyük olasılıkla bir tetramerik kompleks oluşturduğundan, kanala maksimum dört ligand molekülü bağlanabilir. Seçicilik , ligandın bağlanması için afinitenin diferansiyel kontrolü , kapılamanın etkinliği veya her ikisinin bir kombinasyonu ile elde edilebilir. Bağlanma afinitesi, siklik nükleotitlerin kanala ne kadar sıkı bağlandığı anlamına gelir. Etkinlik, ligandın bağlandıktan sonra kanalı aktive etme ve açma yeteneğini ifade eder. Bu süreçler seçiciliği anlamada faydalı olsa da, deneysel olarak birbirinden ayırmak çok zor olduğu için ayrılmaz bir şekilde birbirine bağlıdırlar.
CNG kanalları Na + ve K + iyonları arasında ayrım yapmaz ve daha yavaş bir hızda da olsa Ca2 + ve Mg2 + 'nın geçmesine de izin verir . Bu iki değerlikli iyonların geçişi Na + ve K + tarafından taşınan akımı engeller . CNG kanallarının seçicilik filtresinde yüksek oranda korunmuş bir glutamik asit kalıntısının Ca2 + için yüksek afiniteli bir bağlanma bölgesi oluşturduğu bulunmuştur . Ayrıca, NaK kanalı olarak adlandırılan seçici olmayan bir bakteri katyon kanalı, CNG kanallarına benzer bir seçicilik filtre dizisine sahiptir. İçinde kristal yapısı NaK kanalının, ayrı bir Ca + 2 gözenek hücre dışı açıklığında sitesi -bağlayıcı tanımlanmıştır.
CNG kanallarının inhibisyonu
Çalışmalar, Xenopus oositlerinde diasilgliserol (DAG) tarafından CNG kanallarının farklı inhibisyonunu göstermiştir . DAG, kapalı durum inhibitörü olarak kullanılabilir. Homomultimerik çubuk kanallarını veya iki veya daha fazla aynı peptit zincirini içerenleri inhibe etmek için DAG kullanılması , doğal çubuk kanallarının inhibisyonuna benzerdi. Homomultimerik koku alma kanallarını inhibe etmek için DAG kullanmak, yüksek DAG konsantrasyonuyla bile o kadar etkili değildi. Bir kanalı etkili bir şekilde inhibe etmek için birden fazla DAG molekülüne ihtiyaç vardır. DAG molekülleri, kanala bağlanarak veya hücre zarının lipid çift tabakası ile kanal arasındaki etkileşimi değiştirerek, bir CNG kanalının yakın durumunu stabilize etmek için kendilerini konumlandırırlar . Kimera çubuğu ve koku alma kanalları ile yapılan çalışmalar , DAG inhibisyonundaki farklılıkların, transmembran segmentinin bağlı döngüsündeki farklılıklardan kaynaklandığını göstermektedir .
fizyolojik önemi
fotoreseptörler
Işığın yokluğunda cGMP , fotoreseptörlerdeki CNG kanallarına bağlanır. Bu bağlanma, kanalların açılmasına neden olur, bu da sodyum (Na + ) ve kalsiyum (Ca 2 + ) iyonlarının hücre içine akmasına ve fotoreseptörün dış bölümünün depolarize olmasına neden olur . Bu depolarize edici iyon akışı karanlık akım olarak bilinir . Tüm Retina gözün ışık tespit, bir fototransdüksiyon kademeli olarak bilinen bir reaksiyon meydana gelir. Bu bir sinyal transdüksiyon yolu enzim aktivasyonuna yol açar fosfodiesteraz , hidrolize cGMP konsantrasyonunu azaltarak, 5'-GMP içine cGMP. cGMP'nin yokluğunda, fotoreseptörlerdeki CNG kanalları kapanır ve yukarıda bahsedilen karanlık akımın akışını engeller. Bu da fotoreseptörün dış segmentinin hiperpolarizasyonuna neden olarak aksiyon potansiyelinin yayılmasını ve glutamat salınımını engeller . Çalışmalar, fotoreseptörlerde cGMP'ye bağlı CNG kanallarının aşırı aktivasyonunun, dejenerasyona yol açabileceğini göstermiştir. Bir fotoreseptör üzerindeki CNG kanalları sürekli olarak aktive edilirse, fotoreseptörün dış segmentine Ca2 + ve Na + iyon akışı artacak ve böylece karanlık akımın ötesinde depolarize olacaktır. Bir pozitif geri besleme döngüsü aracılığıyla, bu daha sonra hücreye Ca2 + akımını artıracaktır . Fotoreseptör hücrede yüksek Ca2 + konsantrasyonu, onun ölümüne programlanmış hücre ölümüne veya apoptoza yol açacaktır .
Retinitis pigmentoza
Retinitis Pigmentosa (RP), hastaların çubuk ve koni fotoreseptörlerinin dejenerasyonundan muzdarip olduğu genetik bir hastalıktır. Kayıp, hastanın periferik görüşünde başlar ve merkezi görme alanına ilerleyerek hastayı orta yaşta kör bırakır.
RP hastalarının yaklaşık %1'inde cGMP alfa alt biriminde mutasyonlar vardır . Sekiz mutasyon tanımlanmıştır - dördü anlamsız mutasyonlardır , biri transkripsiyonel birimin çoğunu içeren bir silmedir . Diğer üçü , C terminalinde amino asit dizisinin kısalmasına yol açan yanlış anlamlı mutasyonlar ve çerçeve kayması mutasyonlarıdır . cGMP kapılı katyon kanallarının yokluğunun neden fotoreseptör bozulmasına neden olduğu hala bilinmemektedir. Rodopsin geninde ve çubuk fototransdüksiyon basamaklarını kodlayan çubuk fosfodiesterazın alfa ve beta alt birimlerinde RP'ye neden olan mutasyonlar da bulunmuştur . Bu alt birimlerin mutasyonu, dolaylı olarak çubuk cGMP kapılı kanal fonksiyonunu bozar, bu da ortak bir fotoreseptör bozunma mekanizması olduğu anlamına gelir.
kalp pili hücreleri
Sinir sistemi, kalp ve bazı iç organlarda hücreler, organın ritmini belirleyen siklik nükleotid kapılı kanallar içerir. Resmi olarak hiperpolarizasyonla aktive olan siklik nükleotid kapılı kanallar ( HCN kanalları ) olarak adlandırılan bu kanallar, bu kritik işlev nedeniyle "pacemaker kanalları" olarak da adlandırılır. Adından da anlaşılacağı gibi, hiperpolarizasyon koşullarında açık ve depolarizasyon sırasında kapalıdırlar. Bunun sinoatriyal düğümde (ve yedek olarak atriyoventriküler düğümde ) önemi, kalp her atıştan sonra sıfırlandığında veya hiperpolarize olduğunda, HCN kanallarının açılması ve pozitif iyonların hücreye girmesine izin vermesidir. komik akım ), başka bir depolarizasyon olayını ve ardından kalp kasılmasını tetikler. Bu kalbe otomatikliğini verir. HCN kanalı ile birlikte çalışan birincil siklik nükleotid cAMP'dir.
Koku duyu nöronları
Koku alma duyu nöronlarındaki (OSN'ler) koku maddelerine verilen hemen hemen tüm tepkiler CNG kanalları tarafından kolaylaştırılır. Bir koku verici , kemosensitif silia membranındaki spesifik reseptörüne bağlandığında , bir G proteinini aktive eder , bu da adenilil siklaz (AC) enzimini aktive eden bir akış aşağı reaksiyona neden olur . Bu enzim, OSN içindeki cAMP konsantrasyonundaki bir artıştan sorumludur. cAMP, OSN membranındaki CNG kanallarına bağlanır, onları açar ve hücreyi Ca2 +'ya karşı oldukça geçirgen hale getirir . Kalsiyum iyonları hücre içine akar ve depolarizasyona neden olur . Diğer tüm hücre tiplerinde olduğu gibi OSN'lerde de CNG kanalları Na +' nın hücre içine akmasına izin verir . Ek olarak, hücre içindeki artan Ca2 + konsantrasyonu, Ca2 + bağımlı klorür (Cl - ) kanallarını aktive eder, bu da hücre içi Cl - iyonlarının hücre dışına akmasına neden olarak depolarizasyon olayını arttırır. Bu depolarizasyon , nihai olarak koku vericinin alımını işaret eden bir aksiyon potansiyelini uyarır . OSN'lerin küçük bir alt kümesi, cAMP kapılı iyon kanallarına ek olarak, CNGA3 alt birimini içeren cGMP seçici CNG kanallarına da sahiptir.
spermatozoa
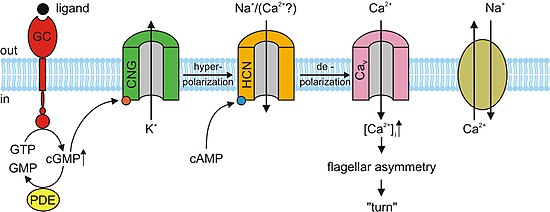
cAMP ve cGMP , akrozomal ekzositoz veya erkek sperminin dişi yumurtasına füzyonu ve kemotaksi gibi çeşitli hücresel tepkilere aracılık eder . In kestanesi deniz türlerinin, Strongylocentrotus purpuratus , speract, kısa peptit , çalışılmıştır. Specact, bir reseptör tipi guanilat siklazı (GC) aktive eder ve hücre içi cGMP konsantrasyonlarında bir artışı uyarır . Specact ayrıca kalsiyum konsantrasyonunu da arttırır . Henüz doğrudan bir nedensel ilişki kurulmamış olmasına rağmen, daha önce bahsedilen gözlemler, cGMP'nin kalsiyum iletkenliğini aktive ettiğini göstermektedir . CNG kanalları, yüksek kalsiyum geçirgenlikleri nedeniyle kalsiyum giriş yolu için başlıca adaylardır. CNG kanalları henüz homoloji taraması ile tespit edilmemiştir. Olarak , memelilerde , testis ifade edilmiştir CNG kanalı alt birimleri, A3, B1, ve B3 vardır. Heterolog ekspresyon A3 alt biriminin edildi klonlanmış gelen testis ve cGMP duyarlı ve seçici olan kanal üretilir. Bu kanalların sperm içine cGMP ile uyarılan kalsiyum akışına dahil olması mümkündür . Bununla birlikte, kanal aktivitesini tespit etmedeki düşük başarı oranı nedeniyle kanalın daha kapsamlı bir karakterizasyonu gerçekleştirilememiştir. A3 alt birimi yana nakavt fareler vardır bereketli , CNG kanalları motilite denetim çeşit ve hatta kemotaktik yüzme davranış veya akrozomal ekzositoz dahil edilebilir. Bununla birlikte, memeli sperminde reseptör tipi bir GC henüz tanımlanmamıştır. Fare spermi, CatSper1 gibi diğer kanalları ifade eder . Erkek kısırlığı, CatSper1 genini bozarak gerçekleştirilebilir; ek olarak, cAMP ile indüklenen kalsiyum akışı, mutant farelerde ortadan kaldırılır . CatSper'ın işlevsel hale gelmesi için ek alt birimlere ihtiyacı olmasına rağmen , bunlar CNG kanallarıyla ilgisizdir çünkü CatSper'da bir cAMP/cGMP bağlama yeri yoktur. CNG ve CatSper alt birimlerinin, kalsiyum geçirgen ve siklik nükleotide duyarlı iyon kanalları oluşturmak üzere bir araya gelmesi mümkündür.
Böbrek
cGMP'ye duyarlı kanallar böbrek medullasında , özellikle vücudun elektrolit ve sıvı dengesini etkileyen kanal hücrelerinin toplanmasında analiz edilmiştir . CNG kanal aktivitesi, cGMP'nin fosforilasyon mekanizmalarına dahil olması nedeniyle cGMP'ye bağımlı protein kinaz ve G1 proteini arasındaki etkileşim tarafından kontrol edilir . Bir iç medüller toplama kanalından gelen hücrelerde, CNG kanalları, katyon seçicilik birim iletkenliği, kalsiyum geçirgenliği ve siklik nükleotid kapılı iyon kanallarına çok benzer farmakoloji sergiler . Bir uyarıcı olan atriyal natriüretik faktör (ANF) , böbreklerde cGMP üretimini arttırır, bu da gevşetici ve kasılan arteriyollerin bir kombinasyonu ile glomerulusun işlevini arttırır . Retinal ve renal cDNA arasındaki farklar, bu iki dokudaki CNG kanalları arasındaki fonksiyonel farklılıklarla ilişkilendirilmiştir.
Gonadotropin salgılatıcı hormon
Gonadotropin salgılatıcı hormon (GrH) salgılayan bir nöronal hücre dizisinde CNG iyon kanalı alt birimleri A2, A4 ve B1 tanımlanmıştır . Üç alt birim , OSN'lerin kemosensitif kirpikleri üzerindeki CNG kanallarını oluşturur . Yüksek hücre dışı kalsiyumda, çubuklardaki ve OSN'lerdeki CNG kanallarının birim iletkenliği, nöronal hatta ölçülenlerden önemli ölçüde daha küçüktür. CNG kanallarının büyük birim iletkenliği yaratacağı şüpheli görünüyor.
Bitkiler
Bitkilerdeki CNG iyon kanalları amino asit dizilimi ve yapısı bakımından hayvanlardaki seçici olmayan katyon CNG kanallarına ve ayrıca zar-ötesi alan K + seçici çalkalayıcı aile kanallarına benzerdir . Ancak, yalnızca bitki CNG kanallarında görülen ciddi farklılıklar vardır. Bitki CNG kanallarındaki gözenek dizisinin amino asit dizisi, hayvan CNG kanallarında bulunan seçicilik filtresinden ve ayrıca K + - seçicilik filtre dizisinde bir glisin - tirozin - glisin - aspartat (GYGD) motifinden yoksundur. Bitki CNG kanallarında, özellikle siklik nükleotid bağlama alanında (CNBD) diğer dizi farklılıkları görülür . Bitkilerde, Calmodulin bağlama alanının (CaMBD), CNG kanallarının CNBD'sinde a-sarmal C ile örtüştüğü bulunmuştur . Hayvanlarda CaMBD'ler, CNBD'den çok uzakta bulunur. CNG kanalları, bitki bağışıklığında ve patojenlere veya harici enfeksiyöz ajanlara tepkide büyük rol oynar . Ayrıca bitkilerde apoptozla da ilişkilendirilmişlerdir . CNG iyon kanallarının da bitkilerde polen gelişiminde rol oynadığı düşünülmektedir , ancak bu mekanizmadaki kesin rolü hala bilinmemektedir.
Hayvan CNG kanallarından farklı olarak, bitki CNG kanalları yapılarına göre biyokimyasal olarak kapsamlı bir şekilde analiz edilmemiştir.
prokaryotlar
CNG iyon kanalları, memeli CNG kanallarına yüksek derecede dizi ve yapısal benzerlik paylaşır. Memeli CNG kanalları gibi, siklik nükleotitlerin CNBD'lere bağlanmasının kanal aktivitesini düzenlediği ve kanal konformasyonel durumunu değiştirdiği gösterilmiştir. Bu kanallar spirochaeta ve leptospira türlerinde henüz yakın zamanda tanımlandığından , bu organizmalarda kesin fizyolojik işlevleri bilinmemektedir. İle kombinasyon halinde ışıkla aktive adenilil siklaz , bunlar kullanılmıştır Optogenetic engelleme araçları aksiyon potansiyeli nöronlarda üretimi.
Mevcut ve gelecekteki araştırmalar
Araştırmacılar, görme ve koku almada CNG iyon kanallarının işlevleriyle ilgili birçok önemli soruyu yanıtladılar . Diğer fizyolojik alanlarda, CNG kanallarının rolü daha az tanımlanmıştır. Teknolojik büyümeyle birlikte, bu mekanizmaları anlamak için artık daha fazla olasılık var.
Çünkü nitrik oksit (NO) cGMP sentezini uyarılmasında rol oynar, daha ileri araştırmalar, özellikle OSNs CNG kanallarının modifikasyonda, CNG kanalları NO fizyolojik etkileşimini anlamak için yürütülmektedir.
Bilim adamları, bağlanma bölgelerinin ve alt birimlerin arayüzlerinin etkileşiminde yer alan mekanizmaya katkıda bulunuyorlar. Bu, işbirlikçi olmayan CNG kanallarında mevcut olmayabilir. Bağlanma yeri ve geçidin tek bir alt birime bağlı olması da mümkündür. Bu fikirleri geliştirmek için çift elektron-elektron rezonansı (DEER) ve hızlı sabitleme teknikleri bu mekanik hareketleri gösterebilir.
2007'de yapılan bir çalışma, bitkilerdeki çok sayıda CNG kanalına ek olarak çeşitli ve karmaşık düzenleyici özellikler nedeniyle, bitki CNG kanallarını araştırmak için çok disiplinli bir çalışma yapılması gerektiğini öne sürüyor. Mart 2011'deki bir başka çalışma, bitkilerdeki CNG kanallarının daha iyi anlaşılmasına yardımcı olan son ters genetik verilerini tanır ve ayrıca bitkilerde CNGC aracılı sinyal iletimindeki yukarı ve aşağı faktörleri belirlemek için ek araştırmaların yapılmasını önerir.
Bilim adamları, DAG'ın inhibisyon sırasında doğrudan CNG kanalına bağlanıp bağlanmadığını düşünüyor. DAG'nin kendisini kanaldaki transmembran alanlarına sokması mümkündür. DAG'ın kendisini kanal ve çift katman arasındaki arayüze sokması da mümkündür. DAG inhibisyonunun moleküler mekanizması hala tam olarak anlaşılamamıştır.