oksianyon - Oxyanion
Bir oksianyon veya oksoanyon , genel formül A'ya sahip bir iyondur.
xÖz -
y(burada A bir kimyasal elementi ve O bir oksijen atomunu temsil eder ). Oksiyanyonlar, kimyasal elementlerin büyük çoğunluğu tarafından oluşturulur . Basit oksianyonların formülleri oktet kuralına göre belirlenir . Bir oksianyonun karşılık gelen oksiasidi , H bileşiğidir.
zbir
xÖ
y. Yoğunlaştırılmış oksianyonların yapıları, çokyüzlüler arasında köşelerin veya kenarların paylaşılmasıyla AO n çokyüzlü birimleri açısından rasyonalize edilebilir . Oksianyonlar (özellikle fosfat ve polifosfat esterleri), adenosin monofosfat ( AMP ), adenosin difosfat ( ADP ) ve adenosin trifosfat (ATP) biyolojide önemlidir.
monomerik oksianyonlar
Monomerik oksianyonların formülü , AOm -
n, A elementinin oksidasyon durumu ve periyodik tablodaki konumu tarafından belirlenir . İlk sıranın elemanları maksimum 4 koordinasyon sayısı ile sınırlıdır. Bununla birlikte, ilk sıra elemanlarının hiçbirinde bu koordinasyon sayısına sahip bir monomerik oksianyon yoktur. Bunun yerine karbonat ( CO2−
3) ve nitrat ( HAYIR-
3) merkez atom ve oksijen atomları arasında π bağı bulunan üçgen düzlemsel bir yapıya sahiptir . Bu π bağı, merkezi atom ve oksijenin boyutlarının benzerliği ile desteklenir.
Grup oksidasyon durumundaki ikinci sıra elementlerin oksianyonları tetrahedraldir . dörtyüzlü SiO
4birimleri olivin minerallerinde bulunur, [Mg,Fe]SiO
4, ancak oksijen atomları katı halde katyonlar tarafından tetrahedral olarak çevrelendiğinden anyonun ayrı bir varlığı yoktur. Fosfat ( PO3−
4), sülfat ( SO2−
4) ve perklorat ( ClO-
4) iyonları çeşitli tuzlarda olduğu gibi bulunabilir. Düşük oksidasyon durumundaki elementlerin birçok oksianyonu, oktet kuralına uyar ve bu, kabul edilen formülleri rasyonelleştirmek için kullanılabilir. Örneğin, klor(V) iki değerlik elektronuna sahiptir, bu nedenle oksit iyonlarıyla bağlardan üç elektron çifti barındırabilir. İyon üzerindeki yük +5 − 3 × 2 = -1'dir ve dolayısıyla formül ClO'dur.-
3. İyonun yapısının, VSEPR teorisi tarafından , üç bağ elektron çifti ve bir yalnız çift ile piramidal olduğu tahmin edilmektedir . Benzer şekilde, klor(III)'ün oksianyonu ClO formülüne sahiptir.-
2, ve iki yalnız çift ve iki bağ çifti ile bükülür.
| Paslanma durumu | isim | formül | resim |
|---|---|---|---|
| +1 | hipoklorit iyonu | ClO - |

|
| +3 | klorit iyonu |
ClO- 2 |

|
| +5 | klorat iyonu |
ClO- 3 |

|
| +7 | perklorat iyonu |
ClO- 4 |

|
Periyodik tablonun üçüncü ve sonraki sıralarında 6-koordinasyon mümkündür, ancak izole edilmiş oktahedral oksianyonlar çok yüksek bir elektrik yükü taşıyacakları için bilinmemektedir. Böylece molibden(VI) MoO oluşturmaz6−
6, ancak tetrahedral molibdat anyonunu oluşturur, MoO2−
4. MoO 6 birimleri yoğunlaştırılmış molibdatlarda bulunur. Oktahedral yapıya sahip tamamen protonlanmış oksianyonlar, Sn(OH) gibi türlerde bulunur.2−
6ve Sb(OH)-
6. Ek olarak, ortoperiodat H ile sadece kısmen protonlanabilir.
3GÇ2−
6||⇌|| H
2GÇ3−
6|| + H + olan p K bir = 11.60.
adlandırma
Monomerik oksianyonların adlandırılması aşağıdaki kurallara göre yapılır.
- Merkez atom Grup VII veya VIII'de değilse
| Merkezi atom oksidasyon numarası | adlandırma şeması | Örnekler |
|---|---|---|
| = Grup numarası | *-yemek yedi |
Borat ( BO3− 3), Karbonat ( CO2− 3), Nitrat ( HAYIR- 3), Fosfat ( PO3− 4), Sülfat ( SO2− 4), Kromat ( CrO2− 4), Arsenat ( AsO3− 4), Ferrat ( FeO2− 4) |
| = Grup numarası − 2 | *-it |
Nitrit ( HAYIR- 2), Fosfit ( PO3− 3), Sülfit ( SO2− 3), Arsenit ( ASO3− 3) |
| = Grup numarası − 4 | hipo-*-ite |
Hipofosfit ( PO3− 2), Hiposülfit ( SO2− 2) |
- Merkez atom Grup VII veya VIII'de ise
| Merkezi atom oksidasyon numarası | adlandırma şeması | Örnekler |
|---|---|---|
| = Grup numarası | başına-*-yemiş |
Perklorat ( ClO- 4), Perbromat ( BrO- 4), Noktalama ( IO- 4), Permanganat ( MnO- 4), Perksenat ( XeO4− 6) |
| = Grup numarası − 2 | *-yemek yedi |
Klorat ( ClO- 3), Bromat ( BrO- 3), İyodat ( IO- 3) |
| = Grup numarası − 4 | *-it |
Klorit ( ClO- 2), Bromit ( BrO- 2) |
| = Grup numarası − 6 | hipo-*-ite | Hipoklorit (ClO − ), Hipobromit ( BrO − ) |
yoğunlaşma reaksiyonları
Sulu çözeltide, yüksek yüklü oksianyonlar, dikromat iyonu, Cr oluşumunda olduğu gibi yoğuşma reaksiyonlarına girebilir.
2Ö2−
7:
- 2 cro2−
4+ 2 H + ⇌ Kr
2Ö2−
7+ H 2 O
Bu reaksiyonun itici gücü, anyon üzerindeki elektriksel yük yoğunluğunun azalması ve H + iyonunun ortadan kaldırılmasıdır . Çözelti içinde sipariş miktarı belirli bir miktar serbest azaltılır entropi yapan Gibbs serbest enerjisi daha negatif ve ileri reaksiyonu destekler. Bir baz olarak hareket eden monomerik oksianyonun ve onun konjuge asidi olarak hareket eden yoğunlaştırılmış oksianyonun olduğu bir asit-baz reaksiyonunun bir örneğidir . Ters reaksiyon, bir baz olarak hareket eden bir su molekülü olarak bölündüğü için bir hidroliz reaksiyonudur . Adenozin fosfatlarda olduğu gibi, özellikle daha yüksek yüklü anyonlarda daha fazla yoğunlaşma meydana gelebilir.

|
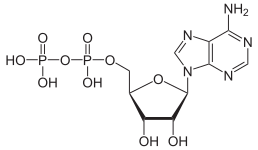
|
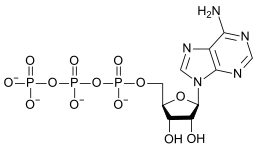
|
| AMP | ADP | ATP |
ATP'nin ADP'ye dönüşümü bir hidroliz reaksiyonudur ve biyolojik sistemlerde önemli bir enerji kaynağıdır.
Çoğu silikat mineralinin oluşumu, silisin bir bazik oksit ile reaksiyona girdiği bir de-yoğunlaşma reaksiyonunun sonucu olarak görülebilir , Lux-Flood anlamında bir asit-baz reaksiyonu .
- CaO (baz) + SiO 2 (asit) → CaSiO 3
Polioksianyonların yapıları ve formülleri
Bir polioksianyon , genellikle MO n polihedra olarak kabul edilen çoklu oksianyon monomerlerinin köşeleri veya kenarları paylaşarak birleştirildiği bir polimerik oksianyondur . Bir polihedronun iki köşesi paylaşıldığında ortaya çıkan yapı bir zincir veya bir halka olabilir. Örneğin polifosfatlarda kısa zincirler oluşur . Gibi Inosilicates, piroksenler SiO uzun bir zincire sahip 4 tetrahedra her paylaşan iki köşeleri. Aynı yapı, amonyum metavanadat , NH 4 VO 3 gibi meta-vanadatlar olarak adlandırılanlarda da meydana gelir .
oksianyon SiO formülü2−
3şu şekilde elde edilir: her bir nominal silikon iyonu (Si 4+ ) iki nominal oksit iyonuna (O 2− ) bağlıdır ve diğer ikisinde yarı paya sahiptir. Böylece stokiyometri ve yük şu şekilde verilir:
- Stokiyometri: Si + 2 O + (2 × 1 ⁄ 2 ) O = SiO 3
- Yük: +4 + (2 × −2) + (2 × ( 1 ⁄ 2 × −2)) = −2.
Bir halka, iki ucun birleştiği bir zincir olarak görülebilir. Döngüsel trifosfat , P
3Ö3−
9 bir örnektir.
Üç köşe paylaşıldığında yapı iki boyuta uzanır. Gelen amfiboller , (ki asbest iki zincir, zincir boyunca alternatif yerler üçüncü köşesinin paylaşarak birbirine bağlanmış bir örnektir). Bu ideal bir formül Si ile sonuçlanır
4Ö6−
11ve bu minerallerin lifli yapısını açıklayan doğrusal bir zincir yapısı. Üç köşenin hepsinin paylaşılması, mika , Si'de olduğu gibi bir tabaka yapısına neden olabilir.
2Ö2−
5, her silikonun kendisine bir oksijeni ve diğer üçünde yarı payı vardır. Kristalin mika çok ince tabakalara bölünebilir.
Dörtyüzlülerin dört köşesinin hepsinin paylaşılması, kuvars gibi 3 boyutlu bir yapı ile sonuçlanır . Alüminosilikatlar , bazı silikonların alüminyum ile değiştirildiği minerallerdir. Bununla birlikte, alüminyumun oksidasyon durumu, silisyumunkinden bir eksiktir, bu nedenle yer değiştirmeye başka bir katyonun eklenmesi eşlik etmelidir. Böyle bir yapının olası kombinasyonlarının sayısı çok fazladır, bu da kısmen bu kadar çok alüminosilikat bulunmasının nedenidir.
Oktahedral MO 6 birimleri, daha büyük geçiş metallerinin oksianyonlarında yaygındır. Zincir polimerik iyon tuzları gibi bazı bileşikler, Mo
2Ö2−
7hatta hem tetrahedral hem de oktahedral birimleri içerir. Kenar paylaşımı, oktahedral yapı taşları içeren iyonlarda yaygındır ve oktahedra, köprü oluşturan oksijen atomlarındaki gerilimi azaltmak için genellikle bozulur. Bu, polioksometalatlar adı verilen 3 boyutlu yapılarla sonuçlanır . Tipik örnekler , fosfomolibdat iyonunun Keggin yapısında meydana gelir . Kenar paylaşımı, iki oktahedra içeren varsayımsal yoğuşma reaksiyonunda görülebileceği gibi, elektriksel yük yoğunluğunu azaltmanın etkili bir yoludur:
- 2 AYn -
6+ 4 H + → Mo
2Ö( n -4)−
10+ 2H 2 O
Burada, her M atomu üzerindeki ortalama yük 2 azalır. Kenar paylaşımının etkinliği, alkalin sulu bir molibdat çözeltisi asitleştirildiğinde meydana gelen aşağıdaki reaksiyonla gösterilir.
- 7 Ay2−
4+ 8 H + ⇌ Mo
7Ö6−
24+ 4H 2 O
Tetrahedral molibdat iyonu, her molibdende ortalama 6 ⁄ 7 yük veren 7 kenar bağlantılı oktahedradan oluşan bir kümeye dönüştürülür . Heptamolibdat kümesi o kadar kararlıdır ki, 2 ila 6 molibdat birimine sahip kümeler, ara ürünler olarak oluşturulmaları gerekse bile tespit edilememiştir.
asitlik için buluşsal
İlgili asitlerin pKa'sı, oksijene çift bağ sayısından tahmin edilebilir. Bu nedenle perklorik asit çok güçlü bir asit iken hipoklorik asit çok zayıftır. Basit bir kural genellikle yaklaşık 1 pH birimi içinde çalışır.
Asit-baz özellikleri
Çoğu oksianyon zayıf bazlardır ve asitler veya asit tuzları vermek üzere protonlanabilir. Örneğin, fosfat iyonu, fosforik asit oluşturmak için art arda protonlanabilir.
-
PO3−
4+ H + ⇌ HPO2−
4 -
HPO2−
4+ H + ⇌ H
2PO-
4 -
H
2PO-
4+ H + ⇌ H 3 PO 4
Sulu çözeltideki protonasyonun kapsamı, asit ayrışma sabitlerine ve pH'a bağlı olacaktır . Örneğin, AMP (adenozin monofosfat) p sahip k bir çok pH 7'de bu protonlanmış yaklaşık% 10 olacaktır, 6.21 değerini. Bu protonasyon reaksiyonlarında yük nötralizasyonu önemli bir faktördür. Buna karşılık, tek değerlikli anyonlar perklorat ve permanganat iyonlarının protonlanması çok zordur ve bu nedenle karşılık gelen asitler güçlü asitlerdir .
Fosforik asit gibi asitler, H olarak yazılır rağmen 3 PO 4 , formül aynı zamanda şu şekilde yazılabilir böylece, proton hidroksil grubu oluşturan oksijen atomu bağlı OP (OH) 3 daha iyi bir yapı yansıtacak. Sülfürik asit aşağıdaki gibi yazılabilir O 2 S (OH) 2 ; bu, gaz fazında gözlemlenen moleküldür.
Fosfit iyonu, PO3−
3, güçlü bir bazdır ve bu nedenle her zaman en az bir proton taşır. Bu durumda proton, HPO yapısı ile doğrudan fosfor atomuna bağlanır.2−
3. Bu iyonu oluştururken, fosfit iyonu bir Lewis bazı gibi davranır ve Lewis asidine H + bir çift elektron bağışlar .
Yukarıda belirtildiği gibi, bir yoğuşma reaksiyonu aynı zamanda bir asit-baz reaksiyonudur. Birçok sistemde hem protonasyon hem de yoğunlaşma reaksiyonları meydana gelebilir. Kromat iyonu durumu nispeten basit bir örnek sağlar. Gelen baskınlığı diyagramı sağda gösterilen kromat, PCR negatif açılımı logaritma krom konsantrasyonunun ve pH değeri , H negatif logaritması anlamına gelir + iyonu konsantrasyonu. İki bağımsız denge vardır. Denge sabitleri aşağıdaki gibi tanımlanır.
cro2−
4+ H + ⇌ HCrO-
4günlük K 1 = 5,89 2 HCrO-
4⇌ Kr
2Ö2−
7+ H 2 Ogünlük K 2 = 2.05
Baskınlık diyagramı aşağıdaki gibi yorumlanır.
- kromat iyonu, CrO2−
4, yüksek pH'da baskın türdür. pH yükseldikçe kromat iyonu, pH > 6,75 olan çözeltilerdeki tek tür olana kadar her zamankinden daha baskın hale gelir. - pH < p K 1'de hidrojen kromat iyonu, HCrO-
4 seyreltik çözeltide baskındır. - dikromat iyonu, Cr
2Ö2−
7, yüksek pH hariç, daha konsantre çözeltilerde baskındır.
H 2 CrO 4 ve HCr türleri
2Ö-
7 sadece çok düşük pH'da oluştukları için gösterilmemiştir.
Vanadatlar , molibdatlar ve tungstatlar gibi birçok polimerik tür oluşturulabildiğinde baskınlık diyagramları çok karmaşık hale gelebilir . Diğer bir komplikasyon ise, yüksek polimerlerin çoğunun aşırı yavaş oluşmasıdır, öyle ki denge aylar içinde bile sağlanamayabilir, bu da denge sabitlerinde ve baskınlık diyagramında olası hatalara yol açar.







![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2-}} ][\mathrm {H^{ +}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)
![K_{2}={\frac {[{\mathrm {Cr_{2}O_{7}^{{2-}}}}]}{[{\mathrm {HCrO_{4}^{-}}}] ^{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)