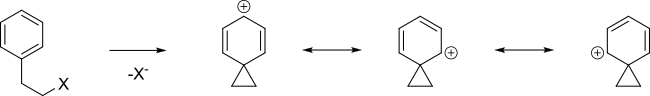
Komşu grup katılımı - Neighbouring group participation
Organik kimyada komşu grup katılımı ( NGP ) ( ankimerik yardım olarak da bilinir ) IUPAC tarafından bir reaksiyon merkezinin bir atomdaki yalnız bir çift elektronla veya bir sigma bağında veya içinde bulunan pi bağında bulunan elektronlarla etkileşimi olarak tanımlanmıştır . ana moleküldür, ancak reaksiyon merkezi ile konjuge değildir . NGP çalışırken reaksiyon hızının artması normaldir . Normal bir reaksiyonla karşılaştırıldığında, reaksiyonun stereokimyasının anormal (veya beklenmedik) olması da mümkündür . Komşu grupların organik kimyadaki birçok reaksiyonu etkilemesi mümkün olsa da ( örneğin 1,3-sikloheksadien gibi bir dienin maleik anhidrit ile reaksiyonu normal olarak ikincil bir etki nedeniyle endo izomeri verir {karbonil grubu π orbitallerinin üst üste binmesi ile Diels-Alder reaksiyonundaki geçiş durumu }) bu sayfa, karbokasyonlar ve S N 2 reaksiyonları ile görülen komşu grup etkileriyle sınırlıdır .
heteroatom yalnız çiftleri tarafından NGP
Bu tip ikame reaksiyonunda, substratın bir grubu başlangıçta reaksiyona katılır ve böylece reaksiyonu etkiler. NGP reaksiyon hızının birçok kat artması nedeniyle Stokiyometrik olarak ürün retansiyona uğrar Nükleofil değişikliklerinin saldırı pozisyonu NGP'nin klasik bir örneği, reaksiyondur. bir nükleofil içeren bir kükürt veya nitrojen mustard için, reaksiyon hızı, sülfür mustard ve bir nükleofil için , heteroatomsuz bir birincil alkil klorür için olduğundan çok daha yüksektir .
Ph-S-CH = 2 -CH 2 , -Cl reaksiyona girer 600 kat daha hızlı su ile CH 3 -CH 2 -CH 2 , -Cl, reaksiyonu etkilemeyen ilk reaksiyonda substrat katıldığı bir ikame reaksiyonu bir grubun Bu tip ve böylece. Ngp reaksiyon hızının birçok kat artması nedeniyle Stokiyometrik olarak ürün retansiyona uğrar Nükleofil atak pozisyonu değişir
bir alken tarafından NGP
Bir alkenin π orbitalleri , karbokasyonun pozitif yükünün delokalize edilmesine yardımcı olarak bir geçiş durumunu stabilize edebilir . Örneğin doymamış tosilat , bir nükleofil ile doymuş tosilattan daha hızlı reaksiyona girer ( sulu solvoliz için 10 11 kat daha hızlı).
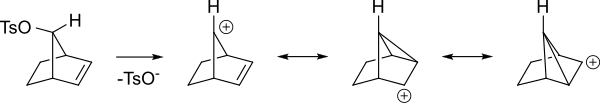
Karbokatyonik ara madde , pozitif yükün birkaç atom üzerine yayıldığı yerde rezonans ile stabilize edilecektir . Aşağıdaki şemada bu gösterilmiştir.
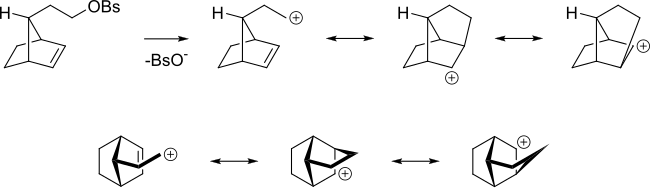
İşte aynı ara maddelerin farklı bir görünümü.
Alken, reaksiyona giren merkezden daha uzak olsa bile, alken yine de bu şekilde hareket edebilir. Örneğin aşağıdaki alkil benzensülfonatta alken, karbokasyonu delokalize edebilir .
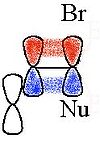
Ayrıca, n-propil bromürün reaksiyonuyla karşılaştırıldığında , allil bromürün bir nükleofil ile S N2 reaksiyonunun hızındaki artış , π bağının orbitallerinin geçiş durumununkilerle örtüşmesidir . Alil sisteminde alken orbitalleri, bir S N2 geçiş durumunun orbitalleri ile örtüşür .
Bir siklopropan, siklobütan veya bir homoalil grubu tarafından NGP
Siklopropilmetil klorür etanol ve su ile reaksiyona sokulursa , %48 siklopropilmetil alkol, %47 siklobutanol ve %5 homoalil alkol (but-3-enol) karışımı elde edilir. Bunun nedeni, karbokatyonik ara ürünün, tersinir bir halka açıklığı yoluyla birçok farklı karbon üzerine yer değiştirmesidir.
Aromatik bir halka ile NGP
Bir durumunda benzil S, çünkü halid reaktivite daha yüksektir , N 2 geçiş durumu alil sisteminde edilene benzer bir çakışma etkisi sahiptir.
Bir aromatik halka , pozitif yükün yerini değiştirerek bir fenonyum iyonu adı verilen bir karbokatyonik ara maddenin oluşumuna yardımcı olabilir .
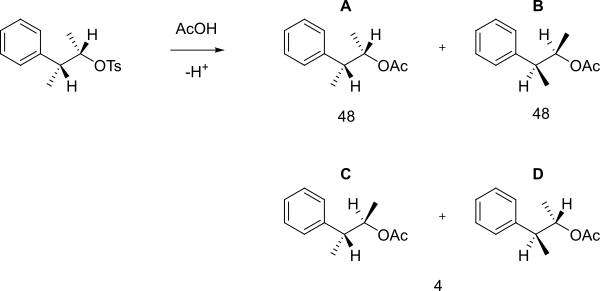
Aşağıdaki tosilat , solvolizde asetik asit ile reaksiyona girdiğinde, B'yi oluşturan basit bir S N2 reaksiyonu yerine , A, B (enantiyomerler olan) ve C+D'nin 48:48:4'lük bir karışımı elde edildi.
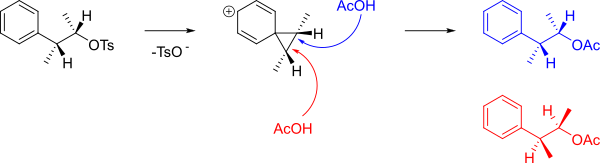
A ve B'yi oluşturan mekanizma aşağıda gösterilmiştir.
Alifatik CC veya CH bağları ile NGP
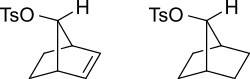
Alifatik CC veya CH bağları, bu bağlar, ayrılan gruba yakın ve antiperiplanar ise, yükün yer değiştirmesine yol açabilir. Karşılık gelen ara maddeler , en iyi bilinen durum olarak 2-norbornil sistemi ile klasik olmayan iyonlara atıfta bulunur .
Dış bağlantılar
Referanslar
- ^ Gelişmiş organik kimya, sayfa 314, Jerry March (4. Baskı), Wiley-Interscience.
- ^ Stereokimya Çalışmaları. I. stereospesifik Wagner-Meervvein düzenlenmesi ve izomerlerinin 3-fenil-2-butanol Donald J. Cram J. Am. Kimya Soc. ; 1949; 71(12); 3863-3870. Öz
- ^ Stereokimya Çalışmaları. V. 3-Fenil-2-bütanol Sisteminde Meydana Gelen Molekül İçi Yeniden Düzenlemelerde ve Solvoliz Reaksiyonlarında Ara Madde Olarak Fenonyum Sülfonat İyon çiftleri Donald J. Cram J. Am. Kimya Soc. ; 1952; 74(9); 2129-2137Özet.