manyetokimya - Magnetochemistry
Manyetokimya , kimyasal bileşiklerin manyetik özellikleri ile ilgilidir . Manyetik özellikler, bir bileşikte bulunan elektronların spin ve yörünge açısal momentumundan kaynaklanır. Bileşikler, eşlenmemiş elektron içermediklerinde diyamanyetiktir . Bir ya da daha çoğunu ihtiva moleküler bileşikler çiftlenmemiş elektrona olan paramanyetik . Paramanyetizmanın büyüklüğü, etkili bir manyetik moment, μ eff olarak ifade edilir . Birinci sıra geçiş metalleri için μ eff'nin büyüklüğü, ilk yaklaşımda, eşleşmemiş elektron sayısının basit bir fonksiyonudur, sadece spin formülüdür. Genel olarak, spin-yörünge kuplajı , μ eff'nin salt spin formülünden sapmasına neden olur . Daha ağır geçiş metalleri, lantanitler ve aktinitler için spin-yörünge eşleşmesi göz ardı edilemez. Değişim etkileşimi kümelerde ve sonsuz kafeslerde meydana gelebilir ve bireysel spinlerin göreli yönelimlerine bağlı olarak ferromanyetizma , antiferromanyetizma veya ferrimanyetizma ile sonuçlanır .
Manyetik alınganlık
Manyetokimyada birincil ölçüm manyetik duyarlılıktır. Bu, maddenin bir manyetik alana yerleştirilmesiyle etkileşimin gücünü ölçer. Hacmi manyetik duyarlılık sembolü ile temsil edilen, ilişkiyle tanımlanır
burada, bir mıknatıslanma malzemeden (bir manyetik dipol momenti ölçülen birim hacmi başına), amper metre başına ( SI birimleri), ve bir manyetik alan şiddeti da metre başına amper cinsinden ölçülür. Duyarlılık boyutsuz bir niceliktir . Kimyasal uygulamalar için molar manyetik duyarlılık (χ mol ) tercih edilen miktardır. m 3 ·mol -1 (SI) veya cm 3 ·mol -1 (CGS) olarak ölçülür ve şu şekilde tanımlanır:
burada ρ kg·m −3 (SI) veya g·cm −3 (CGS) cinsinden yoğunluktur ve M , kg·mol -1 (SI) veya g·mol -1 (CGS) cinsinden molar kütledir .
Manyetik duyarlılığın ölçümü için çeşitli yöntemler mevcuttur.
- İle Gouy denge numunesinin ağırlık değişikliği bir ölçülür analitik terazi numune, homojen bir manyetik alan içinde yerleştirildiğinde. Ölçümler, cıva kobalt tiyosiyanat, HgCo(NCS) 4 gibi bilinen bir standarda göre kalibre edilir . Kalibrasyon, numunenin yoğunluğunu bilme ihtiyacını ortadan kaldırır. Numuneyi mıknatısın kutup parçaları arasındaki bir kriyostat içine yerleştirerek değişken sıcaklık ölçümleri yapılabilir .
- Evans dengesi . sabit bir konumda bir numune ve mıknatısları ilk konumlarına geri getirmek için değişken bir ikincil mıknatıs kullanan bir burulma terazisidir . O da HgCo(NCS) 4'e karşı kalibre edilmiştir .
- Bir Faraday terazisi ile numune, sabit gradyanlı bir manyetik alana yerleştirilir ve bir burulma terazisinde tartılır. Bu yöntem, manyetik anizotropi hakkında bilgi verebilir .
- SQUID çok hassas bir manyetometredir.
- Çözeltideki maddeler için duyarlılığı ölçmek için NMR kullanılabilir.
Manyetik davranış türleri
İzole bir atom manyetik bir alana yerleştirildiğinde , atomdaki her elektron bir mıknatıs gibi davrandığından, yani elektronun manyetik bir momenti olduğu için bir etkileşim vardır . İki tür etkileşim vardır.
- Diamanyetizma. Bir manyetik alana yerleştirildiğinde atom manyetik olarak polarize olur, yani indüklenmiş bir manyetik moment geliştirir. Etkileşimin kuvveti, atomu manyetik alanın dışına itme eğilimindedir. Geleneksel olarak diyamanyetik duyarlılığa negatif bir işaret verilir. Çok sık olarak diamanyetik atomların eşleşmemiş elektronları yoktur, yani her elektron aynı atomik yörüngede başka bir elektronla eşleştirilmiştir . İki elektronun momentleri birbirini yok eder, dolayısıyla atomun net manyetik momenti olmaz. Bununla birlikte, altı eşleşmemiş elektronu olan Eu 3+ iyonu için yörünge açısal momentumu elektron açısal momentumunu iptal eder ve bu iyon sıfır Kelvin'de diyamanyetiktir.
- Paramanyetizma. En az bir elektron diğeriyle eşlenmemiş. Atomun kalıcı bir manyetik momenti vardır. Bir manyetik alana yerleştirildiğinde, atom alanın içine çekilir. Konvansiyonel olarak paramanyetik duyarlılığa pozitif bir işaret verilir.
Atom kimyasal bir bileşikte bulunduğunda, manyetik davranışı kimyasal ortamı tarafından değiştirilir. Manyetik momentin ölçümü yararlı kimyasal bilgiler verebilir.
Belirli kristal malzemelerde bireysel manyetik momentler birbiriyle hizalanabilir (manyetik momentin hem büyüklüğü hem de yönü vardır). Bu ferromanyetizma , antiferromanyetizma veya ferrimanyetizmaya yol açar . Bunlar bir bütün olarak kristalin kimyasal özellikleri üzerinde çok az etkisi olan özelliklerdir.
Diyamanyetizma
Diamanyetizma, kimyasal bileşiklerin evrensel bir özelliğidir, çünkü tüm kimyasal bileşikler elektron çiftleri içerir. Eşlenmemiş elektronların bulunmadığı bir bileşiğe diyamanyetik denir. Etki zayıftır çünkü indüklenen manyetik momentin büyüklüğüne bağlıdır. Elektron çiftlerinin sayısına ve ait oldukları atomların kimyasal doğasına bağlıdır. Bu, etkilerin toplamsal olduğu ve bir "diyamanyetik katkılar" tablosunun veya Pascal sabitlerinin bir araya getirilebileceği anlamına gelir. Paramanyetik bileşiklerle, gözlemlenen duyarlılık, tablodaki değerlerle hesaplanan diyamanyetik duyarlılık olan sözde diyamanyetik düzeltme eklenerek ayarlanabilir.
paramanyetizma
Mekanizma ve sıcaklık bağımlılığı
Bir koordinasyon kompleksinde Cu2 + gibi eşleşmemiş tek bir elektrona sahip bir metal iyonu , paramanyetizma mekanizmasının en basit örneğini sağlar. Tek tek metal iyonları ligandlar tarafından birbirinden uzak tutulur, böylece aralarında manyetik bir etkileşim olmaz. Sistemin manyetik olarak seyreltik olduğu söyleniyor. Atomların manyetik dipolleri rastgele yönlere işaret eder. Bir manyetik alan uygulandığında, birinci dereceden Zeeman bölünmesi meydana gelir. Alana hizalanmış spinlere sahip atomlar, hizalanmamış spinlere sahip atomlardan biraz daha fazladır. Birinci dereceden Zeeman etkisinde, iki durum arasındaki enerji farkı, uygulanan alan kuvveti ile orantılıdır. Enerji farkını Δ E olarak ifade eden Boltzmann dağılımı , iki popülasyonun oranını verir; burada k , Boltzmann sabitidir ve T , kelvin cinsinden sıcaklıktır . Çoğu durumda Δ E , kT'den çok daha küçüktür ve üstel, 1 – Δ E/kT olarak genişletilebilir . Bu ifadede 1/ T'nin varlığından , duyarlılığın sıcaklıkla ters orantılı olduğu sonucu çıkar.
Bu, Curie yasası olarak bilinir ve orantı sabiti C , Curie sabiti olarak bilinir ve molar duyarlılık için değeri şu şekilde hesaplanır.
burada N , Avogadro sabitidir , g , Landé g-faktörüdür ve μ B , Bohr magnetonudur . Bu işlemde, elektronik temel durumun dejenere olmadığı, manyetik duyarlılığın yalnızca elektron dönüşünden kaynaklandığı ve yalnızca temel durumun termal olarak doldurulduğu varsayılmıştır .
Bazı maddeler Curie yasasına, bazıları ise Curie-Weiss yasasına uyar .
T C olan Curie sıcaklığı . Curie-Weiss yasası, yalnızca sıcaklık Curie sıcaklığının çok üzerinde olduğunda geçerli olacaktır. Curie sıcaklığının altındaki sıcaklıklarda madde ferromanyetik hale gelebilir . Daha ağır geçiş elemanları ile daha karmaşık davranış gözlenir.
Etkili manyetik moment
Curie yasasına uyulduğunda, molar duyarlılık ve sıcaklığın ürünü sabittir. Etkin manyetik momenti , μ eff aşağıdaki gibi tanımlanır
Cı CGS birimleri cm sahip olması halinde 3 mol -1 K, μ eff olduğu
Cı SI sahip olması durumunda birim m 3 mol -1 K, μ eff olduğu
μ eff miktarı fiilen boyutsuzdur, ancak genellikle Bohr magneton (μ B ) birimleriyle ifade edilir .
Curie yasasına uyan maddeler için etkin manyetik moment sıcaklıktan bağımsızdır. Diğer maddeler için μ eff sıcaklığa bağlıdır, ancak Curie-Weiss yasası geçerliyse ve Curie sıcaklığı düşükse bağımlılık küçüktür.
Sıcaklıktan bağımsız paramanyetizma
Diyamanyetik olması beklenen bileşikler bu tür zayıf paramanyetizma sergileyebilir. Alan kuvvetinin karesiyle orantılı ek bölmenin meydana geldiği ikinci dereceden bir Zeeman etkisinden kaynaklanır. Bileşik kaçınılmaz olarak diyamanyetik anlamda manyetik alanla da etkileşime girdiğinden gözlemlemek zordur. Bununla birlikte, permanganat iyonu için veriler mevcuttur . Uranil bileşikleri gibi daha ağır elementlerin bileşiklerinde gözlemlenmesi daha kolaydır .
Exchange etkileşimleri
Değişim etkileşimleri, madde manyetik olarak seyrelmediğinde ve bireysel manyetik merkezler arasında etkileşimler olduğunda meydana gelir. Değişimi etkileşimlerinin sonucu sergilediği basit sistemlerden biri kristalin olan bakır (II) asetat , bakır 2 (OAc) 4 (lH 2 O) 2 . Formülün gösterdiği gibi, iki bakır(II) iyonu içerir. Cu2 + iyonları, her biri her iki bakır iyonuna bağlanan dört asetat ligandı tarafından bir arada tutulur. Her Cu 2+ iyonu ad 9 elektronik konfigürasyona sahiptir ve bu nedenle bir eşleşmemiş elektrona sahip olmalıdır. Bakır iyonları arasında kovalent bir bağ olsaydı, elektronlar eşleşir ve bileşik diyamanyetik olurdu. Bunun yerine, eşleşmemiş elektronların spinlerinin kısmen birbirine hizalandığı bir değişim etkileşimi vardır. Aslında iki durum yaratılır, biri paralel, diğeri karşıt spinli. İki eyalet arasındaki enerji farkı o kadar küçüktür ki popülasyonları sıcaklıkla önemli ölçüde değişir. Sonuç olarak manyetik moment, sigmoidal bir modelde sıcaklıkla değişir . Spinlerin zıt olduğu durum daha düşük enerjiye sahiptir, dolayısıyla bu durumda etkileşim antiferromanyetik olarak sınıflandırılabilir. Bunun, asetat ligandlarının oksijen ve karbon atomlarının aracılık ettiği bir süper değişim örneği olduğuna inanılmaktadır . Diğer dimerler ve kümeler değişim davranışı sergiler.
Değişim etkileşimleri, tek boyutta sonsuz zincirler, iki boyutta düzlemler veya üç boyutta bütün bir kristal üzerinde hareket edebilir. Bunlar, uzun menzilli manyetik sıralama örnekleridir. Bireysel dönüşlerin doğasına ve göreceli yönelimlerine bağlı olarak ferromanyetizma , antiferromanyetizma veya ferrimanyetizmaya yol açarlar .
Curie sıcaklığının altındaki sıcaklıklardaki bileşikler, ferromanyetizma şeklinde uzun menzilli manyetik düzen sergiler. Diğer bir kritik sıcaklık , altında antiferromanyetizmanın meydana geldiği Néel sıcaklığıdır . Nikel klorür hekzahidrat, NiCl 2 · 6H 2 O, 8,3 K Néel sıcaklığına sahiptir. Duyarlılık bu sıcaklıkta maksimumdur. Néel sıcaklığının altında duyarlılık azalır ve madde antiferromanyetik hale gelir.
Geçiş metal iyonlarının kompleksleri
Bir veya daha fazla eşleşmemiş elektrona sahip bir geçiş metal iyonu içeren bir bileşik için etkin manyetik moment , sırasıyla eşleşmemiş elektronların toplam yörünge ve dönüş açısal momentumuna ve , bağlıdır. Bu bağlamda "toplam", " vektör toplamı " anlamına gelir . Metal iyonlarının elektronik durumlarının Russell-Saunders eşleşmesi ile belirlendiği ve spin-yörünge eşleşmesinin ihmal edilebilir olduğu yaklaşımında, manyetik moment şu şekilde verilir:
Yalnızca döndürme formülü
Yörünge açısal momentumu, dejenere bir yörünge kümesinin yörüngesindeki bir elektron, kümedeki başka bir yörüngeye dönme yoluyla hareket ettiğinde üretilir. Düşük simetri komplekslerinde belirli rotasyonlar mümkün değildir. Bu durumda yörünge açısal momentumunun "söndürüldüğü" ve beklenenden daha küçük (kısmi söndürme) veya sıfır (tam söndürme) olduğu söylenir . Aşağıdaki durumlarda tam bir söndürme vardır. Dejenere bir d x 2 –y 2 veya d z 2 orbital çiftindeki bir elektronun simetri nedeniyle diğer yörüngeye dönemediğine dikkat edin.
Söndürülmüş yörünge açısal momentumu d n oktahedral dört yüzlü yüksek dönüş düşük dönüş d 1 e 1 gün 2 e 2 gün 3 t 2g 3 d 4 t 2g 3 e g 1 d 5 t 2g 3 e g 2 d 6 t 2g 6 e 3 t 2 3 gün 7 t 2g 6 e g 1 e 4 t 2 3 d 8 t 2g 6 e g 2 d 9 t 2g 6 e g 3
- açıklama: t 2g , t 2 = (d xy , d xz , d yz ). e g , e = (d x 2 –y 2 , d z 2 ).
Yörünge açısal momentumu tamamen söndürüldüğünde ve paramanyetizma yalnızca elektron dönüşüne atfedilebilir. Toplam dönüş açısal momentumu, eşleşmemiş elektronların sayısının yarısıdır ve sadece dönüş formülü sonuçları.
burada n eşleşmemiş elektronların sayısıdır. Yalnızca spin formülü, birinci sıra geçiş metallerinin yüksek spinli kompleksleri için iyi bir ilk yaklaşımdır .
İyon
Eşlenmemiş
elektron sayısıYalnızca
dönme momenti /μ Bgözlemlenen
moment /μ BTi 3+ 1 1.73 1.73 V 4+ 1 1.73 1.68–1.78 Cu 2+ 1 1.73 1.70–2.20 V + 3 2 2.83 2,75–2,85 Ni 2+ 2 2.83 2,8–3,5 V2 + 3 3.87 3.80-3.90 Cr 3+ 3 3.87 3,70-3,90 Ortak 2+ 3 3.87 4.3–5.0 Mn 4+ 3 3.87 3.80–4.0 Cr 2+ 4 4.90 4,75-4,90 Fe 2+ 4 4.90 5.1–5.7 Mn 2+ 5 5.92 5,65–6,10 Fe 3+ 5 5.92 5.7–6.0
Sadece spin formülündeki küçük sapmalar, yörüngesel açısal momentumun veya spin-yörünge bağlaşmasının ihmal edilmesinden kaynaklanabilir. Örneğin, dört yüzlü d 3 , d 4 , d 8 d 9 yörünge katkı "söndürme" yüzlü durumda daha az etkili olduğu kompleksler, aynı iyonunun oktahedral komplekslerine göre eğirme sadece formül büyük sapmalar gösterir eğilimi .
Düşük dönüşlü kompleksler
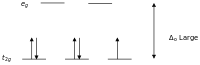
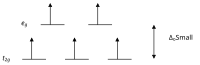
Kristal alan teorisine göre, bir oktahedal kompleks içindeki bir geçiş metal iyonunun d orbitalleri, bir kristal alanda iki gruba ayrılır. Bölünme, elektronları zıt dönüşlü aynı yörüngeye yerleştirmek için gereken enerjinin üstesinden gelecek kadar büyükse, düşük dönüşlü bir kompleks ortaya çıkar.
Yüksek ve düşük spinli oktahedral kompleksler d-sayısı Eşleşmemiş elektron sayısı örnekler yüksek dönüş düşük dönüş d 4 4 2 Cr 2+ , Mn 3+ d 5 5 1 Mn 2+ , Fe 3+ d 6 4 0 Fe 2+ , Co 3+ gün 7 3 1 Ortak 2+
Bir eşleşmemiş elektronla μ eff değerleri 1,8 ila 2,5 μ B arasında değişir ve iki eşleşmemiş elektronla aralık 3,18 ila 3,3 μ B'dir . Fe 2+ ve Co 3 +' nın düşük spinli komplekslerinin diyamanyetik olduğuna dikkat edin. Diamanyetik olan diğer bir kompleks grubu, Ni 2+ ve Rh + ve Au 3+ gibi d 8 iyonlarının kare düzlemsel kompleksleridir .
Çapraz döndürme
Yüksek spin ve düşük spin durumları arasındaki enerji farkı kT ile karşılaştırılabilir olduğunda (k, Boltzmann sabiti ve T sıcaklıktır), spin durumları arasında "elektronik izomerler" olarak adlandırılanları içeren bir denge kurulur. Tris- dithiocarbamato demir (III), Fe (S 2 CNR 2 ) 3 , iyi belgelenmiş bir örnektir. Etkili bir an tipik d değişir 5 2.25 μ düşük dönme değeri B fazla 4 μ 80 K B 300 K yukarıda
2. ve 3. sıra geçiş metalleri
Kristal alan bölünmesi, daha ağır geçiş metallerinin kompleksleri için yukarıda tartışılan geçiş metallerine göre daha büyüktür. Bunun bir sonucu, düşük dönüşlü komplekslerin çok daha yaygın olmasıdır. Spin-yörünge birleştirme sabitleri, ζ, ayrıca daha büyüktür ve temel işlemlerde bile göz ardı edilemez. Manyetik davranış, kapsamlı bir veri tablosuyla birlikte aşağıdaki gibi özetlenmiştir.
d-sayısı kT / ζ = 0.1
μ effkT / ζ = 0
μ effBüyük spin-yörünge kuplaj sabiti ile davranış, ζ nd d 1 0.63 0 μ eff T 1/2 ile değişir gün 2 1.55 1.22 μ eff , T'ye göre değişir, yaklaşık olarak gün 3 3.88 3.88 Sıcaklıktan bağımsız d 4 2.64 0 μ eff T 1/2 ile değişir d 5 1,95 1.73 μ eff , T'ye göre değişir, yaklaşık olarak
Lantanitler ve aktinitler
Russell-Saunders eşleşmesi , LS eşleşmesi, lantanit iyonları için geçerlidir, kristal alan etkileri göz ardı edilebilir, ancak spin-yörünge eşleşmesi ihmal edilebilir değildir. Sonuç olarak, spin ve yörünge açısal momentumu birleştirilmelidir.
ve hesaplanan manyetik moment ile verilir
Üç değerlikli lantanit bileşiklerinin manyetik özellikleri lantanit Ce Halkla İlişkiler Nd öğleden sonra Sm AB Gd yemek dy Ho Er Tm yb lu eşleştirilmemiş elektron sayısı 1 2 3 4 5 6 7 6 5 4 3 2 1 0 hesaplanan moment /μ B 2.54 3.58 3.62 2.68 0.85 0 7.94 9.72 10.65 10.6 9.58 7,56 4.54 0 gözlemlenen moment /μ B 2.3–2.5 3.4–3.6 3.5–3.6 1.4–1.7 3.3–3.5 7,9-8,0 9,5-9,8 10.4–10.6 10.4–10.7 9.4-9.6 7.1–7.5 4.3–4.9 0
Aktinidlerde spin-yörünge bağlantısı güçlüdür ve bağlantı j j bağlantısına yaklaşır .
Bu, etkili anı hesaplamanın zor olduğu anlamına gelir. Örneğin, [UCl 6 ] 2− kompleksindeki uranyum(IV), f 2 , sıcaklıktan bağımsız paramanyetizmadan bir katkıyı içeren ölçülen 2.2 μ B etkin momentine sahiptir .
Ana grup elementler ve organik bileşikler

Ana grup elementlerinin çok az bileşiği paramanyetiktir. Dikkate değer örnekler şunları içerir: oksijen , O 2 ; nitrik oksit , NO; nitrojen dioksit , NO 2 ve klor dioksit , ClO 2 . Olarak organik kimya , eşleşmemiş elektron bileşikler olduğu söylenmektedir serbest radikaller . Serbest radikaller, bazı istisnalar dışında kısa ömürlüdür, çünkü bir serbest radikal diğeriyle hızla reaksiyona girer, bu nedenle manyetik özelliklerini incelemek zordur. Bununla birlikte, eğer radikaller, katı bir matris içindeki seyreltik bir çözelti içinde, düşük sıcaklıkta birbirinden iyi ayrılırlarsa, elektron paramanyetik rezonansı (EPR) ile incelenebilirler . Bu tür radikaller ışınlama ile üretilir. Kapsamlı EPR çalışmaları, serbest radikallerde elektron delokalizasyonu hakkında çok şey ortaya çıkardı. CH simüle spektrumu 3 • radikali gösterir aşırı ince bölme bağlı 1/2 bir spin, her biri 3 eşdeğer hidrojen çekirdekleri ile elektron etkileşimine.
Spin etiketleri , EPR tarafından incelenebilmeleri için organik moleküllere eklenebilen uzun ömürlü serbest radikallerdir. Örneğin, nitroksit MTSL , tetra metil piperidin oksit, bir işlevselleştirilmiş türevi TEMPO , kullanılan bölgeye yönelik sıkma etiketleme .
Uygulamalar
Gadolinyum iyonu, Gd + 3 , f sahip 7 tüm paralel spin ile, elektronik konfigürasyonu. Gd olan bileşikler 3+ iyonu olarak kullanım için en uygun olan kontrast ajanı için MRI taramaları . Gadolinyum bileşiklerinin manyetik momentleri, herhangi bir geçiş metal iyonunun manyetik momentlerinden daha büyüktür. Gadolinyum, dejenere olmayan bir elektronik zemin durumuna sahip olması nedeniyle, bazıları daha büyük etkili momentlere sahip olan diğer lantanit iyonlarına tercih edilir .
Uzun yıllar oksihemoglobin , Hb-O 2'nin doğası oldukça tartışmalıydı. Deneysel olarak diyamanyetik olduğu bulundu. Deoksi-hemoglobin genellikle +2 bir demir kompleksi olduğu kabul edilmektedir oksidasyon durumunda reklam olduğu, 6 4.9 μ spin-tek değere yakın bir yüksek eğirme manyetik momenti bulunan bir sistem B . Demirin oksitlenmesi ve oksijenin süperoksite indirgenmesi önerildi.
- Fe (II) Hb (yüksek spin) + O 2 ⇌ [Fe (III) Hb] O 2 -
Fe elektronların kadar Eşleştirme 3+ ve O 2 - daha sonra bir değişim mekanizması ile meydana önerilmiştir. Şimdi, bir oksijen molekülü demire bir çift elektron bağışladığında, aslında demir(II)'nin yüksek-spinden düşük-spin'e değiştiği gösterilmiştir. Deoksi-hemoglobinde demir atomu hem düzleminin üzerinde yer alırken, düşük spinli komplekste etkin iyonik yarıçap azalır ve demir atomu hem düzleminde bulunur.
- Fe(II)Hb + O 2 ⇌ [Fe(II)Hb]O 2 (düşük dönüşlü)
Bu bilgi, yapay oksijen taşıyıcıları bulma araştırmaları üzerinde önemli bir etkiye sahiptir .
Galyum(II) bileşikleri oldukça yakın zamana kadar bilinmiyordu. Galyumun atom numarası tek bir sayı (31) olduğundan, Ga 2+ eşleşmemiş bir elektrona sahip olmalıdır. Serbest radikal gibi davranacağı ve çok kısa bir ömre sahip olacağı varsayılmıştır . Ga(II) bileşiklerinin yokluğu, sözde inert çift etkisinin bir parçasıydı . [GaCl 3 ] − gibi ampirik formüle sahip anyonun tuzları sentezlendiğinde diyamanyetik oldukları bulundu. Bu, bir Ga-Ga bağının ve bir dimerik formül olan [Ga 2 Cl 6 ] 2− oluşumunu ima etti .
Ayrıca bakınız
- manyetik mineraloji
- manyetoelektrokimya
- Manyetik iyonik sıvı
- Buz sıkmak
- Spin cam
- Superdiamagnetism , süperparamanyetizma , Superferromagnetism
- Tek moleküllü manyetizma
Referanslar
bibliyografya
- Carlin, RL (1986). Manyetokimya . Springer . ISBN'si 978-3-540-15816-5.
- Earnshaw, Alan (1968). Manyetokimyaya Giriş . Akademik Basın .
- Figgis, BN; Lewis, J. (1960). "Karmaşık Bileşiklerin Manyetokimyası". Lewis'te. J. ve Wilkins. RG (ed.). Modern Koordinasyon Kimyası . New York: Wiley .
- Greenwood, Norman N. ; Earnshaw, Alan (1997). Elementlerin Kimyası (2. baskı). Butterworth-Heinemann . ISBN'si 978-0-08-037941-8.
- Orchard, AF (2003). Manyetokimya . Oxford Kimya Astarları. Oxford University Press . ISBN'si 0-19-879278-6.
- Selwood, PW (1943). Manyetokimya . Interscience Publishers Inc.
- Vulfson, Sergey (1998). Moleküler Manyetokimya . Taylor ve Francis . ISBN'si 90-5699-535-9.