Debye–Hückel denklemi - Debye–Hückel equation
Kimyagerler Peter Debye ve Erich Hückel , iyonik çözünenler içeren çözeltilerin çok düşük konsantrasyonlarda bile ideal davranmadığını fark ettiler . Bu nedenle, bir çözümün dinamiklerinin hesaplanmasında çözünen maddelerin konsantrasyonu esas olsa da , çözümün aktivite katsayılarının hesaplanması için gama olarak adlandırdıkları fazladan bir faktörün gerekli olduğunu teorileştirdiler . Bu nedenle Debye–Hückel denklemini ve Debye–Hückel sınırlama yasasını geliştirdiler . Aktivite sadece konsantrasyonla orantılıdır ve aktivite katsayısı olarak bilinen bir faktör tarafından değiştirilir . Bu faktör, çözeltideki iyonların etkileşim enerjisini hesaba katar .
Debye-Hückel sınırlama yasası
Hesaplamak için aktivitesi , bir ait iyon bir çözelti içerisinde C, tek bir bilmelidir konsantrasyonu ve aktivite katsayısı:
nerede
- C'nin aktivite katsayısı,
- seçilen standart durumun konsantrasyonudur , örneğin molalite kullanılıyorsa 1 mol/kg ,
- C konsantrasyonunun bir ölçüsüdür.
Bölme ile boyutsuz miktarını verir.
Debye-Hückel sınırlayıcı yasa bir bir iyonun aktivite katsayısını belirlemek için bir olanak sağlar seyreltik bilinen çözelti iyonik gücü . denklem
nerede
- bir yük sayısı iyon türü i ,
- olan , temel yüktür ,
- Debye tarama uzunluğunun tersidir (aşağıda tanımlanmıştır),
- bir nispi dielektrik çözücü,
- olan boş alanın geçirgenlik ,
- olan Boltzmann sabiti ,
- bir sıcaklık çözeltisi,
- olan avagadro ,
- olan iyonik kuvveti çözeltisi (aşağıda tanımlanmıştır),
- sıcaklığa bağlı bir sabittir. Eğer yerine molaritede (yukarıda ve bu maddenin geri kalanında denklemde gibi), molalite cinsinden ifade edilir, daha sonra da bir deneysel değer su olan 25 ° C de. 10 tabanlı bir logaritma kullanmak yaygındır, bu durumda çarpanlarına ayırırız , dolayısıyla A dır . Denklemde önceki çarpan , boyutlarının olduğu durum içindir . boyutları olduğunda , çarpan denklemden çıkarılmalıdır.
Çözeltideki iyonlar birlikte hareket ettiğinden, bu denklemden elde edilen aktivite katsayısının aslında bir ortalama aktivite katsayısı olduğuna dikkat etmek önemlidir.
Debye–Hückel teorisinden elde edilen aşırı ozmotik basınç , cgs birimindedir :
Bu nedenle, toplam basınç, aşırı ozmotik basınç ile ideal basıncın toplamıdır . Ozmotik katsayısı aşağıdaki formülle verilir:
Seyreltik elektrolitler teorisi üzerine Debye ve Hückel'in ilk makalesinin özeti
Makalenin İngilizce başlığı "On the Theory of Electrolytes. I. Donma Noktası Depresyonu ve İlgili Olaylar"dır. İlk olarak 1923'te Almanca yayınlanan Physikalische Zeitschrift dergisinin 24. cildinde yayınlandı . Makalenin İngilizce çevirisi, Debye'ye "öğrencileri, arkadaşları ve yayıncıları tarafından 24 Mart 1954'te yetmişinci doğum günü münasebetiyle" sunulan derleme makalelerden oluşan bir kitapta yer almaktadır. 2019'da bir başka İngilizce çeviri daha tamamlandı. Makale, iyon kaynaklı elektrik alanlarının etkisi altındaki elektrolit çözeltilerinin özelliklerinin hesaplanması ile ilgilidir, dolayısıyla elektrostatik ile ilgilidir .
Bu makaleyi ilk yayınladıkları yıl, bundan sonra D&H olarak anılacak olan Debye ve Hückel, "On the Theory of Electrolytes. II. Elektrik İletkenliği için Sınırlama Yasası" adlı elektrik alanlarının etkisi altındaki çözeltilerin ilk karakterizasyonlarını kapsayan bir makale de yayınladılar. , ancak sonraki makale (henüz) burada ele alınmamıştır.
Aşağıdaki özette (henüz eksik ve kontrol edilmemiş), karışıklığı önlemek için hem kimya hem de matematikten modern gösterim ve terminoloji kullanılmıştır. Ayrıca, anlaşılırlığı artırmak için birkaç istisna dışında, bu özetteki alt bölümler, orijinal makalenin aynı alt bölümlerinin (çok) kısaltılmış versiyonlarıdır.
Tanıtım
D&H , klasik biçimde kimyasal reaksiyon dengesindeki elektrolit türleri için Guldberg-Waage formülünün
nerede
- çarpma için bir gösterimdir ,
- a, kukla değişken türlerini gösterir,
- reaksiyona katılan türlerin sayısı,
- bir mol fraksiyonu türlerinin ,
- olan stokiyometrik katsayısı türlerinin ,
- K bir denge sabiti .
"İyonlar arasında karşılıklı elektrostatik kuvvetler" ile, değiştirerek Guldberg-Waage denklemi değiştirmek için gerekli olan nedeniyle D & H, yani ile , burada bir genel aktivite katsayısı, bir "özel" aktivite katsayısı (ilişkili ayrı bir aktivite katsayısı 2007 itibariyle modern kimyada kullanılan şey budur.
Özel aktivite katsayıları arasındaki ilişki ,
temel bilgiler
D&H, Helmholtz ve Gibbs serbest entropilerini kullanır ve bir elektrolitteki elektrostatik kuvvetlerin onun termodinamik durumu üzerindeki etkisini ifade eder. Spesifik olarak, termodinamik potansiyellerin çoğunu klasik ve elektrostatik terimlere ayırırlar:
nerede
- olan Helmholtz serbest entropi ,
- olduğu entropi ,
- olan iç enerji ,
- bir sıcaklık ,
- olan Helmholtz serbest enerjisi .
D & H vermek toplam diferansiyel arasında olduğu
nerede
Toplam diferansiyelin tanımına göre, bu şu anlama gelir:
hangisi daha ileride yararlıdır.
Daha önce belirtildiği gibi, iç enerji iki kısma ayrılır:
nerede
- klasik kısmı gösterir,
- elektrik kısmını gösterir.
Benzer şekilde, Helmholtz serbest entropisi de iki kısma ayrılır:
D&H, mantığı vermeden,
Görünüşe göre, herhangi bir gerekçe olmadan,
Bunu özellikle belirtmeden, D&H daha sonra , çözücünün sıkıştırılamaz olduğu varsayımını savunurken, gerekli (yukarıdaki) gerekçenin ne olabileceğini verir .
Gibbs serbest entropisinin tanımı ,
nerede olduğunu Gibbs serbest enerjisi .
D&H, toplam diferansiyelini şu şekilde verir:
Bu noktada D&H, litre potasyum klorür başına 1 mol içeren su için (nominal basınç ve sıcaklık verilmemiştir), elektrik basıncının 20 atmosfer olduğunu not eder. Ayrıca, bu basınç seviyesinin 0,001'lik bir göreli hacim değişikliği verdiğine dikkat çekerler. Bu nedenle, elektrik basıncı nedeniyle suyun hacmindeki değişimi ihmal ederler, yazı yazarlar.
ve koy
D&H, Planck'a göre Gibbs serbest entropisinin klasik kısmının şöyle olduğunu söylüyor:
nerede
- bir türdür,
- çözeltideki farklı parçacık türlerinin sayısıdır,
- i türünün parçacık sayısıdır ,
- i türünün partiküle özgü Gibbs serbest entropisi ,
- olan Boltzmann sabiti ,
- i türünün mol kesridir .
Tür sıfır çözücüdür. Küçük harflerin karşılık gelen kapsamlı özelliklerin parçacığa özgü versiyonlarını gösterdiği yerde tanımı aşağıdaki gibidir:
D&H öyle demiyor, ancak fonksiyonel form, ideal bir karışımın bir bileşeninin kimyasal potansiyelinin mol fraksiyonuna işlevsel bağımlılığından türetilebilir .
D&H , bir çözeltinin iç enerjisinin , iyonlarının elektriksel etkileşimiyle azaldığını, ancak bu etkinin, farklı atomlar arasındaki mesafeler için kristalografik yaklaşım kullanılarak belirlenemeyeceğini not eder (toplam hacmin kütleye oranının küp kökü). hacimdeki parçacık sayısı). Bunun nedeni, sıvı bir çözeltide bir kristalden daha fazla termal hareket olmasıdır. Termal hareket, aksi takdirde iyonlar tarafından oluşturulacak olan doğal örgüyü dağıtma eğilimindedir. Bunun yerine, D&H iyonik bir atmosfer veya bulut kavramını tanıtıyor . Kristal kafes gibi, her iyon kendisini hala zıt yüklü iyonlarla çevrelemeye çalışır, ancak daha serbest formdadır; pozitif iyonlardan küçük mesafelerde, negatif iyonları bulma olasılığı daha yüksektir ve bunun tersi de geçerlidir.
Keyfi bir iyon çözeltisinin potansiyel enerjisi
Bir çözümün elektronötralliği şunları gerektirir:
nerede
- çözeltideki i türünün toplam iyon sayısıdır ,
- bir yük sayısı türlerin i .
Türünün bir iyon getirmek için, i bir noktaya, ilk olarak uzak, iyon bulutunun içinde gerektirir etkileşim enerjisini miktarında , bir temel yüktür ve skalar değeri elektrik potansiyeli sahada . Elektrik kuvvetleri oyundaki tek faktör olsaydı, tüm iyonların minimum enerji konfigürasyonu, kapalı bir kafes konfigürasyonunda elde edilirdi. Bununla birlikte, iyonlar birbirleriyle termal dengededir ve nispeten hareket etmekte serbesttirler. Böylece Boltzmann istatistiklerine uyarlar ve bir Boltzmann dağılımı oluştururlar . Tüm türün sayı yoğunlukları bakımından, irilik (genel ortalama) değerleri değişmiş mukabil Boltzmann faktörü , bir Boltzmann sabiti ve sıcaklıktır. Böylece bulutun her noktasında
Sonsuz sıcaklık sınırında, tüm iyonların elektrostatik etkileşimleri dikkate alınmadan düzgün bir şekilde dağıldığına dikkat edin.
Yük yoğunluğu sayısı yoğunluğu ile ilgilidir:
Yük yoğunluğu için bu sonucu elektrostatikten Poisson denklemi ile birleştirirken , Poisson-Boltzmann denkleminin bir formu şu şekilde sonuçlanır:
Bu denklemin çözülmesi zordur ve yük sayısı ile potansiyel alanın gücü arasındaki ilişki için doğrusal süperpozisyon ilkesini izlemez . İsveçli matematikçi Thomas Hakon Gronwall ve işbirlikçileri fiziksel kimyagerler VK La Mer ve Karl Sandved tarafından Physikalische Zeitschrift'ten Taylor serisi genişlemesine başvuran Debye-Huckel teorisinin uzantılarıyla ilgili 1928 tarihli bir makalede çözüldü .
Bununla birlikte, yeterince düşük iyon konsantrasyonları için, lineer bir diferansiyel denklem oluşturmak için üstel fonksiyon için birinci dereceden Taylor serisi açılım yaklaşımı ( için ) kullanılabilir (Hamann, Hamnett ve Vielstich. Electrochemistry. Wiley-VCH. bölüm 2.4. 2). D&H, bu yaklaşımın iyonlar arasında büyük mesafelerde geçerli olduğunu söylüyor; bu, konsantrasyonun düşük olduğunu söylemekle aynı şey. Son olarak, genişlemeye daha fazla terim eklenmesinin nihai çözüm üzerinde çok az etkisi olduğunu kanıtsız olarak iddia ediyorlar. Böylece
Poisson-Boltzmann denklemi şuna dönüştürülür:
çünkü elektronötralite nedeniyle ilk toplam sıfırdır.
Skaler potansiyeli çarpanlara ayırın ve sabit olan artıkları atayın . Ayrıca, izin olmak iyonik kuvveti çözeltisi:
Böylece, temel denklem Helmholtz denkleminin bir formuna indirgenir :
Günümüzde Debye tarama uzunluğu olarak adlandırılmaktadır . D&H, makalelerinde parametrenin önemini kabul eder ve bunu Gouy-Chapman tipinde bir elektriksel çift katman olan iyon atmosferinin kalınlığının bir ölçüsü olarak nitelendirir .
Denklem , bazı keyfi iyonlar alınarak küresel koordinatlarda ifade edilebilir :
Denklemin aşağıdaki genel çözümü vardır ( bunun pozitif bir sabit olduğunu unutmayın ):
nerede , , ve belirsiz sabitlerdir
Elektrik potansiyeli tanım gereği sonsuzda sıfırdır, dolayısıyla sıfır olmalıdır.
Bir sonraki adımda, D&H , atmosferdeki hiçbir iyonun, seçilen iyonun (yük) merkezine yaklaşamayacağı belirli bir yarıçap olduğunu varsayar . Bu yarıçap, iyonun kendisinin fiziksel boyutuna, buluttaki iyonların boyutlarına ve iyonları çevreleyen herhangi bir su molekülüne bağlı olabilir. Matematiksel olarak, seçilen iyonu , yarıçap içinde yaklaşılamayan bir nokta yükü olarak ele alırlar .
Tek başına bir nokta yükünün potansiyeli,
D&H, kürenin içindeki toplam potansiyelin
nerede iyonik atmosfer tarafından eklenen potansiyeli temsil eden bir sabittir. Sabit olmak için hiçbir gerekçe verilmez. Ancak, herhangi bir küresel statik yük dağılımının kabuk teoreminin matematiğine tabi olduğu düşünüldüğünde durumun böyle olduğu görülebilir . Kabuk teoremi, bir küre içindeki (keyfi yüklü) yüklü parçacıklara hiçbir kuvvet uygulanmadığını söyler. İyon atmosferinin (zaman ortalamalı) küresel simetrik olduğu ve yükün yarıçapın bir fonksiyonu olarak değiştiği varsayıldığından , sonsuz bir eşmerkezli yük kabukları serisi olarak temsil edilebilir. Bu nedenle, yarıçap içinde iyon atmosferi hiçbir kuvvet uygulamaz. Kuvvet sıfırsa, potansiyel bir sabittir (tanım gereği).
Poisson-Boltzmann denklemini veren sürekli dağılımlı model ile nokta yük modelinin bir kombinasyonunda, yarıçapta , bir süreklilik ve birinci türevi olduğu varsayılır . Böylece
Elektrik potansiyel enerjisinin tanımına göre , iyon atmosferindeki seçilen iyonla ilişkili potansiyel enerji,
Bunun yalnızca seçilen iyonun yükü ve diğer tüm iyonların potansiyeli hakkında bilgi gerektirdiğine dikkat edin.
Tüm elektrolit çözeltisinin potansiyel enerjisini hesaplamak için, elektrik potansiyel enerjisi için çoklu yük genelleştirmesi kullanılmalıdır:
Termodinamik potansiyele ek elektrik terimi
boyutsuzlaştırma
Diferansiyel denklem çözüme hazırdır (yukarıda belirtildiği gibi, denklem sadece düşük konsantrasyonlar için geçerlidir):
Kullanılması Buckingham π teoremi aşağıdaki boyutsuz gruplar halinde bu sorunun sonuçlarına:
indirgenmiş skaler elektrik potansiyel alanı olarak adlandırılır. azaltılmış yarıçap denir. Mevcut gruplar, diferansiyel denklemde ikame için başka iki boyutsuz grup oluşturmak üzere yeniden birleştirilebilir. İlk azaltılmış karesi denilebilir ne uzunluğunu eleme ters , . İkincisi, azaltılmış merkezi iyon yükü (büyük Z ile) olarak adlandırılabilir. Aşağıda verilen ikame olmadan zaten boyutsuz olmasına rağmen , diferansiyel denklemin hala boyutlu olacağını unutmayın.
Kullanın nondimensionalized diferansiyel denklem ve başlangıç koşulları elde etmek için ortadan kaldırılması için grupları lehine , daha sonra ortadan lehine zincir kuralı gerçekleştirilmesi ve ikame ise , o zaman ortadan lehine (gerekmez zincir kuralı), daha sonra ortadan lehine , sonra lehine ortadan kaldırın . Ortaya çıkan denklemler aşağıdaki gibidir:
25 °C'de 0,01 M çözelti içinde sofra tuzu için, tipik bir değer 0,0005636'dır, tipik bir değer ise 7.017'dir, bu da düşük konsantrasyonlarda, pertürbasyon analizi gibi sıfır büyüklük dereceli bir yaklaşım için bir hedef olduğu gerçeğini vurgulamaktadır. . Ne yazık ki, sonsuzdaki sınır koşulu nedeniyle düzenli pertürbasyon çalışmaz. Aynı sınır koşulu, denklemlerin kesin çözümünü bulmamızı engeller. Bununla birlikte, tekil pertürbasyon işe yarayabilir.
Teorinin deneysel olarak doğrulanması
Debye-Hückel teorisinin geçerliliğini doğrulamak için aktivite katsayılarını ölçen birçok deneysel yol denenmiştir: sorun şu ki çok yüksek seyreltmelere gitmemiz gerekiyor. Tipik örnekler şunlardır: buhar basıncı, donma noktası, ozmotik basınç ölçümleri (dolaylı yöntemler) ve hücrelerdeki elektrik potansiyeli ölçümü (doğrudan yöntem). Yüksek seyreltmelere doğru gidildiğinde, sıvı membran hücreleri kullanılarak iyi sonuçlar bulunmuştur, 10 −4 M sulu ortamları araştırmak mümkün olmuştur ve 1:1 elektrolitler için (NaCl veya KCl olarak) Debye–Hückel denkleminin tamamen olduğu bulunmuştur. doğrudur, ancak 2:2 veya 3:2 elektrolitler için Debye-Hückel sınır yasasından negatif sapma bulmak mümkündür: bu garip davranış sadece çok seyreltik alanda gözlemlenebilir ve daha konsantre bölgelerde sapma pozitif hale gelir. Poisson-Boltzmann denkleminin lineerleşmesi nedeniyle Debye-Hückel denkleminin bu davranışı öngörememiş olması veya belki de olmaması mümkündür: Bununla ilgili çalışmalar ancak 20. yüzyılın son yıllarında başlatılmıştır, çünkü daha önce böyle değildi. t 10-4 M bölgesini araştırmak mümkün , bu nedenle önümüzdeki yıllarda yeni teorilerin doğması mümkün.
Teorinin uzantıları
Yasanın geçerliliğini kimyada yaygın olarak karşılaşılan konsantrasyon aralıklarına genişletmek için bir dizi yaklaşım önerilmiştir.
Böyle bir genişletilmiş Debye-Hückel denklemi şu şekilde verilir:
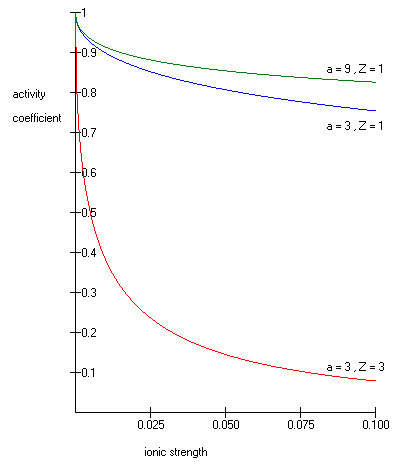
burada onun kadar yaygın logaritma aktivite katsayısı, (H için 1 iyonunun tam sayı ücret + , Mg 2 + 2 gibi), sulu çözeltinin iyonik kuvveti ve boyutu veya etkin çapı arasında angstromda iyon . İyonun etkin hidratlı yarıçapı, a, iyonun yarıçapı ve ona yakın bağlı su molekülleridir. Büyük iyonlar ve daha az yüklü iyonlar, suyu daha az sıkı bağlar ve daha küçük, daha yüksek yüklü iyonlardan daha küçük hidratlı yarıçaplara sahiptir. H + ,Cl - ,CN - ve HCOO - gibi iyonlar için tipik değerler 3Å'dir . Hidronyum iyonu için etkili çap 9Â'dır. ve 25 °C'de suda sırasıyla 0,5085 ve 0,3281 değerlerine sahip sabitlerdir.
Genişletilmiş Debye–Hückel denklemi, μ ≤ 0.1 için doğru sonuçlar sağlar. Daha büyük iyonik kuvvetli çözümler için Pitzer denklemleri kullanılmalıdır. Bu çözümlerde aktivite katsayısı aslında iyonik kuvvetle artabilir.
Debye–Hückel denklemi, misellerin varlığının sistemin elektrokimyasal özelliklerini etkilediği yüzey aktif cisimlerinin çözeltilerinde kullanılamaz (kaba yargı bile ~%50 için γ'yi fazla tahmin eder).
Ayrıca bakınız
Notlar
- ^ http://homepages.rpi.edu/~keblip/THERMO/chapters/Chapter33.pdf , sayfa 9.
- ^ Bir b c d e f g h i j k l m n o P q r s t u v w X y z aa ab AC reklam ae af Peter JW Debye nın toplanan Papers . New York, New York: Interscience Publishers, Inc. 1954.
- ^ P. Debye ve E. Hückel (1923). "Zur Theorie der Elektrolyte. I. Gefrierpunktserniedrigung und verwandte Erscheinungen" . Physikalische Zeitschrift . 24 : 185–206.
- ^ P. Debye ve E. Hückel (1923). "Elektrolit teorisi. 1. Donma noktası depresyonu ve ilgili fenomenler. Çeviren Michael J. Braus (2020)" . Physikalische Zeitschrift . 24 : 185–206.
- ^ Salzman, William R. (2001-08-21). "Karışımlar; Kısmi Molar Miktarlar; İdeal Çözümler" . Kimyasal Termodinamik . Arizona Üniversitesi. Arşivlenmiş orijinal 2007-06-07 tarihinde . 2007-10-23 alındı .
- ^ Http://www.pma.caltech.edu/Courses/ph136/yr2006/text.html Arşivlenen 2007-08-28 at Wayback Machine , bölüm 19.3
- ^ http://guava.physics.uiuc.edu/~nigel/courses/569/Essays_2004/files/lu.pdf bölüm 3.1)
- ^ "LaPlace ve Poisson Denklemleri" .
- ^ "Yüklü bir kürenin elektrik potansiyeli" .
Referanslar
- P. Debye; E. Hückel (1923). "Zur Theorie der Elektrolyte. I. Gefrierpunktserniedrigung und verwandte Erscheinungen" [Elektrolit teorisi. I. Donma noktasının düşmesi ve ilgili olaylar] (PDF) . Physikalische Zeitschrift . 24 : 185–206.
- ^ Hamann, Hamnett ve Vielstich (1998). Elektrokimya . Weinheim: Wiley-VCH Verlag GmbH. ISBN'si 3-527-29096-6.CS1 bakımı: birden çok ad: yazar listesi ( bağlantı )
- ^ Harris, Daniel C. (2003). Kantitatif Kimyasal Analiz (6. baskı). WH Freeman & Company. ISBN'si 0-7167-4464-3.
- ^ Skoog, Douglas A. (Temmuz 2003). Analitik Kimyanın Temelleri . ISBN'si 0-534-41796-5.
- F. Malatesta, R. Zamboni. Sıvı membran hücrelerinin EMF'sinden aktivite ve ozmotik katsayılar, VI - ZnSO4, MgSO4, CaSO4 ve SrSO4 su içinde 25°C'de. Journal of Solution Chemistry 1997, 26, 791–815
Dış bağlantılar
- (Misel olmayan) çözümlerde aktivite katsayılarının kolay hesaplanması için, IUPAC açık proje Aq-çözümlerine (ücretsiz yazılım) göz atın .
- Altın Kitap tanımı




![{\displaystyle a_{C}=\gamma {\frac {[C]}{[C^{\ominus }]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4022edef5c1cba965b065d914671e5910db1e92f)
![{\görüntüleme stili [C^{\ominus }]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca7090587b8389d00b92da68ea39d6df16586c77)
![[C]](https://wikimedia.org/api/rest_v1/media/math/render/svg/798adf333080234dd9da202633a4d63c4ea091aa)