N-asetiltransferaz - N-acetyltransferase
| Arilamin N-asetiltransferaz 2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 İnsan N-asetiltransferaz 2'nin 3 boyutlu çizgi film tasviri
| |||||||||
| tanımlayıcılar | |||||||||
| AB numarası | 2.3.1.5 | ||||||||
| veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| fıçı | Fıçı girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRİAM | profil | ||||||||
| PDB yapıları | RCSB PDB PDBe PDB toplamı | ||||||||
| |||||||||
N-asetiltransferaz (NAT) bir bir enzim katalize transferi asetil gruplarla asetil-CoA için arilaminler , arilhidroksilaminlerin ve arylhydrazines. Aromatik aminler , özellikle serotonin için geniş bir özgüllüğe sahiptirler ve ayrıca CoA'sız arilaminler arasında asetil transferini katalize edebilirler. N-asetiltransferazlar, ksenobiyotikleri asetilleyemeyen köpek ve tilki hariç, çoğu memeli türünün karaciğerinde ve birçok dokusunda bulunan sitozolik enzimlerdir . Asetil grupları , yan ürünlerin atılımını sağlamak için karaciğerden metabolitlerin konjugasyonunda önemlidir ( faz II metabolizma ). Bu özellikle ilaç ürünlerinin metabolizmasında ve atılımında önemlidir ( ilaç metabolizması ).
Enzim Mekanizması
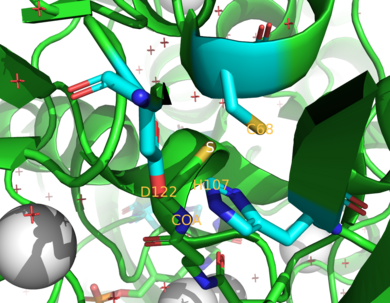
NAT enzimleri, aromatik amin ve hidrazin substratlarını destekleyen korunmuş bir katalitik üçlünün varlığı ile ayırt edilir . NAT'lar , ping pong bi bi reaksiyonu adı verilen bir çift yer değiştirme reaksiyonu yoluyla küçük moleküllerin asetilasyonunu katalize eder . Mekanizma, iki sıralı reaksiyonlar oluşur. Reaksiyonda bir asetil-CoA başlangıçta enzime bağlanır ve Cys 68'i asetiller . İkinci reaksiyonda, asetil-CoA serbest bırakıldıktan sonra, asetil alıcı, ürün oluşturmak için asetillenmiş enzim ile etkileşime girer. Bu ikinci reaksiyon, asetil alıcı bağlanmadan önce enzimi terk ettiğinden, asetil donöründen bağımsızdır. Bununla birlikte, birçok pinpon bi bi reaksiyonunda olduğu gibi, asetil donörü ve asetil alıcısı arasında asetillenmemiş enzim için bir rekabet olması mümkündür. Bu, yüksek konsantrasyonlarda substrata bağlı inhibisyona yol açar.
Enzim Yapısı
İnsanlarda, iki NAT enzimlerdir NAT1 ve NAT2 . Fareler ve sıçanlar, NAT1, NAT2 ve NAT3 olmak üzere üç enzimi eksprese eder. NAT1 ve NAT2'nin şimdiye kadar incelenen türlerde yakından ilişkili olduğu bulunmuştur, çünkü iki enzim amino asit dizilerinin %75-95'ini paylaşır . Her ikisinin de N-terminal bölgesinde aktif bölge sistein kalıntısı (Cys 68 ) vardır. Ayrıca, tüm fonksiyonel NAT enzimleri, bu sistein , histidin ve asparaginden oluşan bir üçlü katalitik olarak temel kalıntı içerir . Göğüs kanseri ilacı Cisplatin'in katalitik etkilerinin Cys 68 ile ilişkili olduğu varsayılmıştır . NAT1'in Cisplatin tarafından etkisizleştirilmesine, aktif bölge sistein kalıntısı ile geri dönüşümsüz bir Cisplatin eklentisi oluşumu neden olur . C-terminali asetil CoA'nın bağlanmasına yardımcı olur ve prokaryotik homologlar dahil NAT'lar arasında farklılık gösterir.
NAT1 ve NAT2, farklı ancak örtüşen substrat özelliklerine sahiptir. İnsan NAT1 tercihen 4-aminobenzoik asit (PABA), 4 amino salisilik asit , sülfametoksazol ve sülfanilamidi asetiller . İnsan NAT2'si tercihen izoniazid ( tüberküloz tedavisi ), hidralazin , prokainamid , dapson , aminoglutetimid ve sülfametazin'i asetiller .
Biyolojik Önemi
NAT2, hem ilaçların inaktivasyonuna hem de kanserojen olabilen toksik metabolitlerin oluşumuna yol açabilen ksenobiyotiklerin metabolizmasında yer alır . Biyotransformasyon Ksenobiyotiklerin üç aşamadan oluşabilir. Faz I'de, substratlara reaktif ve polar gruplar eklenir. Faz II'de, ksenobiyotiklerin yüklü türlerle konjugasyonu meydana gelir ve faz III'te, taşıyıcılar tarafından atılıma yol açan akış mekanizmaları ile ek modifikasyonlar yapılır. Bir genom ilişkilendirme çalışması (GWAS) üst sinyali olarak insan NAT2 tanımlanan insülin direnci , önemli bir işaretleyici diyabet ve önemli bir kardiyovasküler risk faktörü ve NAT1 tüm vücut insülin direnciyle ilişkili olduğu gösterilmiştir knockout farelerde . NAT1'in muhtemelen temel hücresel metabolizma ile bağlantılı endojen bir rolü olduğu düşünülmektedir . Bu, NAT1'in dokular arasında NAT2'den daha yaygın olarak dağılmasıyla ilgili olabilir.
İnsanlarda Önemi
Her birey, ksenobiyotik metabolizma genlerinin polimorfizmlerinden kaynaklanan farklı oranlarda ksenobiyotikleri metabolize eder . Hem NAT1 hem de NAT2, kromozom 8 üzerinde bulunan iki yüksek oranda polimorfik gen tarafından kodlanır . NAT2 polimorfizmleri , ilaç metabolizması için bu bireyler arası değişkenliği açıklayan ilk varyasyonlardan biriydi . Bu polimorfizmler, asetilatör fenotip adı verilen bir özellik olan ilaçlar ve ksenobiyotikler için asetilasyon oranlarını değiştiren enzimlerin stabilitesini ve/veya katalitik aktivitesini değiştirir . NAT2 için asetilatör fenotipi yavaş, orta veya hızlı olarak tanımlanır. Enzimatik aktiviteyi değiştirmenin ötesinde, epidemiyolojik çalışmalar , NAT2 polimorfizmlerinin çeşitli kanserlerle, muhtemelen değişen çevresel karsinojenlerden kaynaklanan bir ilişkisini bulmuştur .
Gerçekten de, NAT2 birçok insan popülasyonunda oldukça polimorfiktir. NAT2 polimorfizmleri, tek amino asit ikameleri R64Q, I114T, D122N, L137F, Q145P, R197Q ve G286E'yi içerir. Bunlar yavaş asetilatörler olarak sınıflandırılırken, vahşi tip NAT2 hızlı asetilatör olarak sınıflandırılır. Yavaş asetilatörler, ilaç toksisitesi ve kanser duyarlılığı ile ilişkili olma eğilimindedir. Örneğin, NAT2 yavaş asetilatör genotipi , özellikle sigara içenler arasında artan mesane kanseri riski ile ilişkilidir . Tek nükleotid polimorfizmi NAT1 bölgesinin (SNP) R64W, V149I, R187Q, M205V, S214A, D251V, E26K, ve I263V içerir ve ilgili genetik yatkınlık için kanser , doğum kusurlarına ve diğer hastalıklar. Kodlama bölgesindeki yavaş asetilatör SNP'lerin etkisi, baskın olarak, ubiquitination ve degradasyondan önce hücre içi olarak toplanan kararsız bir protein oluşturarak hareket eder .
İngiliz nüfusunun %50'si hepatik N-asetiltransferazdan yoksundur. Bu, negatif asetilatör durumu olarak bilinir. Bundan etkilenen ilaçlar şunlardır:
- izoniazid
- prokainamid
- hidralazin
- dapson
- sülfasalazin
Bu eksiklikten kaynaklanan yan etkiler, periferik nöropati ve hepatoksisiteyi içerir . En yavaş asetilatör haplotipi olan NAT2*5B ( mesane kanseri ile en güçlü ilişki ), batı ve orta Avrasya halkında son 6500 yılda seçilmiş gibi görünüyor ve son zamanlardaki olumsuz epidemiyolojik sonuçlara rağmen yavaş asetilasyonun bu popülasyona evrimsel bir avantaj sağladığını düşündürüyor. sağlık sonuçları verileri.
Örnekler
Aşağıdakiler, N-asetiltransferaz enzimlerini kodlayan insan genlerinin bir listesidir :
| Sembol | İsim |
|---|---|
| ANANAT | aralkilamin N-asetiltransferaz |
| ARD1A | ARD1 homolog A, N-asetiltransferaz (S. cerevisiae) |
| GNPNAT1 | glukozamin-fosfat N-asetiltransferaz 1 |
| HGSNAT | heparan-alfa-glukozaminid N-asetiltransferaz |
| MAK10 | MAK10 homologu, amino asit N-asetiltransferaz alt birimi (S. cerevisiae) |
| NAT1 | N-asetiltransferaz 1 (arilamin N-asetiltransferaz) |
| NAT2 | N-asetiltransferaz 2 (arilamin N-asetiltransferaz) |
| NAT5 | N-asetiltransferaz 5 (GCN5 ile ilgili, varsayılan) |
| NAT6 | N-asetiltransferaz 6 (GCN5 ile ilgili) |
| NAT8 | N-asetiltransferaz 8 (GCN5 ile ilgili, varsayılan) |
| NAT8L | N-asetiltransferaz 8 benzeri (GCN5 ile ilgili, varsayılan) |
| NAT9 | N-asetiltransferaz 9 (GCN5 ile ilgili, varsayılan) |
| NAT10 | N-asetiltransferaz 10 (GCN5 ile ilgili) |
| NAT11 | N-asetiltransferaz 11 (GCN5 ile ilgili, varsayılan) |
| NAT12 | N-asetiltransferaz 12 (GCN5 ile ilgili, varsayılan) |
| NAT13 | N-asetiltransferaz 13 (GCN5 ile ilgili) |
| NAT14 | N-asetiltransferaz 14 (GCN5 ile ilgili, varsayılan) |
| NAT15 | N-asetiltransferaz 15 (GCN5 ile ilgili, varsayılan) |