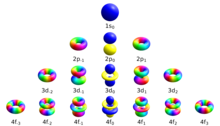Manyetik kuantum sayısı - Magnetic quantum number
Manyetik kuantum sayısı (sembol m L ), dört biridir kuantum sayısı olarak atom fizik . Küme şudur: ana kuantum sayısı , azimut kuantum sayısı , manyetik kuantum sayısı ve spin kuantum sayısı . Birlikte, bir elektronun benzersiz kuantum durumunu tanımlarlar . Manyetik kuantum sayısı, bir alt kabuk içindeki mevcut yörüngeleri ayırt eder ve yörüngenin uzaydaki yöneliminin azimut bileşenini hesaplamak için kullanılır. Belirli bir alt kabuktaki elektronlar (s, p, d veya f gibi) ℓ (0, 1, 2 veya 3) değerleriyle tanımlanır . m l' nin değeri, sıfır dahil olmak üzere - ℓ ile + ℓ arasında değişebilir . Böylece s, p, d ve f alt kabuklarının her biri, sırasıyla 0, ±1, ±2, ±3 aralığında m değerlerine sahip 1, 3, 5 ve 7 yörünge içerir . Bu orbitallerin her biri, periyodik tablonun temelini oluşturan iki elektrona kadar (zıt dönüşlü) barındırabilir .
türetme
Atomun enerji durumları ile ilişkili bir dizi kuantum sayısı vardır. Dört kuantum sayısı , , ve bir atomdaki tek bir elektronun dalga fonksiyonu veya yörüngesi olarak adlandırılan tam ve benzersiz kuantum durumunu belirtir . Schrödinger denklemi bir elektron atomun dalga fonksiyonu için a, ayrılabilir kısmi diferansiyel denklem . (Bu, helyum atomu veya karşılıklı etkileşen elektronlara sahip, çözüm için daha karmaşık yöntemler gerektiren diğer atomlar için geçerli değildir) Bu, küresel koordinatlarda ifade edilen dalga fonksiyonunun, yarıçapın üç fonksiyonunun ürününe bölünebileceği anlamına gelir , colatitude (veya kutup) açısı ve azimut:
diferansiyel denklemi şeklinde çözülebilir . Azimut açısının 2 ile ( radyan cinsinden 360 derece ) farklı değerleri uzayda aynı konumu temsil ettiğinden ve toplam büyüklüğü, gerçek bir üs için olduğu gibi keyfi olarak büyümediğinden , katsayı , tamsayı katlarına nicelleştirilmelidir. , hayali bir üs üreten : . Bu tam sayılar manyetik kuantum sayılarıdır. Aynı sabit bölgesinin daha büyük değerler colatitude denkleminde, görünür 2 büyüklüğünü azaltma eğilimi ve değerleri daha büyük azimut kuantum sayısı için herhangi bir çözüm izin yoktur .
| Kuantum Sayıları Arasındaki İlişki | |||
|---|---|---|---|
| Orbital | değerler | Değer Sayısı | Alt kabuk başına elektron |
| s | 1 | 2 | |
| P | 3 | 6 | |
| NS | 5 | 10 | |
| F | 7 | 14 | |
| G | 9 | 18 | |
açısal momentumun bir bileşeni olarak
Bu analizde kutupsal koordinatlar için kullanılan eksen keyfi olarak seçilir. Kuantum sayısı , geleneksel olarak -yön veya nicemleme ekseni olarak adlandırılan, keyfi olarak seçilen bu yönde açısal momentumun izdüşümünü ifade eder . , -yönündeki açısal momentumun büyüklüğü aşağıdaki formülle verilir:
- .
Bu, atom elektronunun toplam yörünge açısal momentumunun bir bileşenidir ve büyüklüğü aşağıdaki denklemle alt kabuğunun azimut kuantum sayısıyla ilişkilidir :
- ,
burada bir düşük Planck sabiti . Bunun high için ve yaklaşık olarak olduğunu unutmayın . Elektronun açısal momentumunu üç eksen boyunca aynı anda ölçmek mümkün değildir. Bu özellikler ilk olarak Otto Stern ve Walther Gerlach tarafından Stern-Gerlach deneyinde gösterildi .
Herhangi bir dalganın enerjisi, frekansının Planck sabiti ile çarpımıdır. Dalga, kuantum adı verilen parçacık benzeri enerji paketleri görüntüler . Her kuantum durumunun kuantum sayısı için formül, yalnızca belirli veya ayrık veya nicelenmiş enerji seviyelerine izin veren Planck'ın azaltılmış sabitini kullanır.
Manyetik alanlarda etki
Kuantum sayısı , gevşek bir şekilde açısal momentum vektörünün yönünü ifade eder . Manyetik kuantum sayısı , elektronun enerjisini yalnızca bir manyetik alandaysa etkiler çünkü birinin yokluğunda, farklı keyfi değerlere karşılık gelen tüm küresel harmonikler eşdeğerdir. Manyetik kuantum sayısı , bir dış manyetik alan ( Zeeman etkisi ) nedeniyle bir atomik yörüngenin enerji kaymasını belirler - bu nedenle manyetik kuantum sayısı adı . Bununla birlikte, bir atomik orbitaldeki bir elektronun gerçek manyetik dipol momenti , yalnızca elektron açısal momentumundan değil, aynı zamanda spin kuantum sayısında ifade edilen elektron spininden de kaynaklanır .
Her elektron bir manyetik alanda bir manyetik momente sahip olduğundan, vektörü alana paralel hale getirme eğiliminde olan bir torka tabi olacaktır, bu olay Larmor presesyonu olarak bilinir .