İki gözenekli kanal - Two-pore channel
| iki gözenekli segment kanal 1 | |||||||
|---|---|---|---|---|---|---|---|
| tanımlayıcılar | |||||||
| Sembol | TPCN1 | ||||||
| IUPHAR | 392 | ||||||
| NCBI geni | 53373 | ||||||
| HGNC | 18182 | ||||||
| OMIM | 609666 | ||||||
| Referans Sırası | NM_017901 | ||||||
| UniProt | Q9ULQ1 | ||||||
| Diğer veri | |||||||
| yer | Chr. 12 q24.21 | ||||||
| |||||||
| iki gözenekli segment kanal 2 | |||||||
|---|---|---|---|---|---|---|---|
| tanımlayıcılar | |||||||
| Sembol | TPCN2 | ||||||
| IUPHAR | 393 | ||||||
| NCBI geni | 219931 | ||||||
| HGNC | 20820 | ||||||
| Referans Sırası | NM_139075 | ||||||
| UniProt | Q8NHX9 | ||||||
| Diğer veri | |||||||
| yer | Chr. 11 q13.1 | ||||||
| |||||||
İki gözenekli kanallar (TPC'ler), ökaryotik hücre içi voltaj kapılı ve ligand kapılı katyon seçici iyon kanallarıdır . İnsan genomunda bilinen iki paralog vardır, TPC1'ler ve TPC2'ler. İnsanlarda, TPC1'ler sodyum seçicidir ve TPC2'ler sodyum iyonlarını, kalsiyum iyonlarını ve muhtemelen hidrojen iyonlarını iletir. Bitki TPC1'leri seçici olmayan kanallardır. TPC'lerin ifadesi hem bitki vakuollerinde hem de hayvan asidik organellerinde bulunur . Bu organeller endozomlar ve lizozomlardan oluşur . TPC'ler, yarı tetramerler oluşturmak üzere dimerize edilmiş iki transmembran eşdeğer olmayan tandem Shaker benzeri, gözenek oluşturucu alt birimden oluşturulur . Yarı-tetramerler, tetramerlere çok benzer görünür, ancak tamamen aynı değildir. TPC'lerin bazı kilit rolleri, kas kasılma(lar)ındaki kalsiyum bağımlı tepkileri, hormon salgılanmasını, döllenmeyi ve farklılaşmayı içerir. TPC'lerle bağlantılı bozukluklar arasında membran kaçakçılığı , Parkinson hastalığı , Ebola ve yağlı karaciğer bulunur .
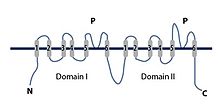
Adlarından da anlaşılacağı gibi, TPC kanalları iki gözenek içerir ve her biri bir gözenek alanına sahip olan iki Shaker benzeri tekrarları için adlandırılmıştır. Bu , kafa karıştırıcı bir şekilde yalnızca bir gözenekli olan ve her bir alt birimin birincil dizisinde iki P (gözenek) alanına sahip olması nedeniyle adlandırılan iki gözenekli alanlı potasyum kanalları ile çelişir .
Tarih ve keşif
TPC işlevi hakkında keşfedilecek çok şey olmasına rağmen, şimdiye kadar kapsamlı bir şekilde incelenmiştir. TPC kanallarının özel işlevi ve bu kanallarla en yakından ilişkili görünen iyonlar ve moleküller hakkında birçok soru ortaya atılmıştır. Bu iyonlardan bazıları sodyum, kalsiyum ve NAADP'dir . TPC'lere ilişkin mevcut bilgiler, fareler ve bitkiler, özellikle Arabidopsis thaliana üzerinde yapılan deneylerden elde edilmiştir . Ayrıca bu kanalların memelilerde lokalizasyonu nedeniyle, bunlar üzerinde elektrofizyolojik kayıtların kullanılması zordur . Bu nedenle, bu TPC kanalları, elektrofizyolojik yöntemler - özellikle yama kelepçesi tekniği kullanılarak çalışılacak bitki vakuolleri gibi hücrenin alternatif bölmelerinde veya organellerinde ifade edilmelidir . Bitki kofullarını net bir şekilde görselleştirmek için bilim adamları deneylerinde floresan mikroskopisine güvendiler . Bu teknikleri kullanarak bilim adamları, memeli TPC işlevleri hakkında sonuçlar çıkarmak için önemli niteliksel veriler toplayabildiler. Spesifik olarak, bilim adamları, insan TPC'sinin ağırlıklı olarak voltaja bağlı sodyum kanalları olduğu ve bir endolizozom spesifik fosfoinositid (PIP) olan PI(3,5)P2'nin, TPC kanallarının doğrudan bir aktivatörü olduğu, ancak NAADP'nin aslında bir aktivatör olmadığı sonucuna varabildiler. aktivatör, daha önce olduğu varsayıldığı gibi.
Yapı ve etki alanları
TPC gözeneğinin ağzında, içinden geçen iyonlarla etkileşime girebilen negatif yüklü dört amino asit kalıntısı vardır. Bu site iyonları seçmek için çok geniş. Negatif yükler grubunun altında, büyük ölçüde hidrofobik olan seçicilik filtresi bulunur. İki özdeş olmayan Shaker benzeri gözenek oluşturan alt birim vardır. Alt birim 1, voltaj algılama alanı 1'den (VSD1) ve alt birim 2, voltaj algılama alanı 2'den (VSD2) oluşur. İki alt birim alanı, bir kalsiyum iyonu bağlama motifine sahip bir EF-el alanı ile ayrılır . Bu bağlanma motifi, sitozolik kalsiyum iyonları tarafından kanal aktivasyonunu kolaylaştırabilir. İki alt birimin her biri 12 transmembran sarmaldan yapılmıştır. İki merkezi gözenek alanı, voltaj algılama alanlarından, VSD1 ve VSD2'den birleştirilir. Hem N-terminal alanı (NTD) hem de C-terminali alanı (CTD), merkezde sitoplazmaya uzanan EF-el alanı ile birlikte sitozolik tarafta uzanır. EF-el alanı, sitozolik kalsiyum tarafından aktive edilebileceği VSD1 ve VSD2 arasında konumlanan sitozole uzanır. VSD2 alanı, voltaja duyarlı aktiftir ve lümendeki kalsiyum tarafından engellenebilir. Bu, aktivasyon durumundan inaktif duruma bir konformasyon değişikliğidir. İki hidrofobik kalıntı halkası sitoplazmadan gözenek boşluğunu kapatır; bu, gözenek kapısının oluşmasına neden olur. Voltaj sensörleri, seçicilik filtresi ve kapı, iyon iletkenliğinin düzenlenmesi için TPC'leri açmak ve kapatmak için koordineli bir şekilde birlikte çalışır.
VSD2 alanı, diğer voltaj kapılı iyon kanalları yapılarına göre normal bir voltaj algılama motifi, arginin tortuları R1, R2 ve R3 ve alfa sarmalı S10 içerir, ancak bu alan bir voltaj sensörünün dinlenme durumunda belirgin bir konformasyon benimser. Lüminal kalsiyum, iyon iletkenliğini önleyen bir TPC1 inhibitörü görevi görür. Luminal tarafta VSD2 için iki kalsiyum bağlama bölgesi vardır. İlk site kanalı etkilemez. VSD2'deki kalıntılardan ve gözenek alanından oluşan Site 2, voltaj bağımlılığını daha pozitif voltajlara kaydırarak kanalı engeller.
TPC'lerin aktivasyonu, transmembran potansiyelindeki bir azalma veya sitozoldeki kalsiyum konsantrasyonlarındaki bir artış ile indüklenir. Lümenin düşük pH'ı ve düşük kalsiyum konsantrasyonu bu kanalların inhibisyonuna neden olabilir. TPC'ler ayrıca hem hayvanlarda hem de bitkilerde fosforilasyon kapılı kanallardır. Fosforilasyon bölgeleri N-terminal ve C-terminal alanlarındadır. Bu terminaller, sitozolden kalsiyum tarafından aktive edilmek üzere allosterik değişiklik sağlayacak şekilde konumlandırılmıştır.
İnsan ve bitki TPC'leri iletkenlik için çok modludur. Kanal açma mekanizması, iyonların TPC'ler yoluyla iletimini yönetmek için muhtemelen kalsiyum konsantrasyonları, voltaj ve fosfor düzenleme entegrasyonunun bir kombinasyonuna katkıda bulunur.
Biyolojik roller (işlev/işlevsizlik)
İki gözenekli kanallar, hücre biyolojik yöntemleri, endolizozomal yama kıskaç teknikleri ve işlevlerini incelemek için çeşitli başka yöntemler kullanılarak analiz edildi . Bunlardan, TPC'lerin endolizozomal veziküllerde luminal pH'ı kontrol etmede bir miktar güce sahip olduğu öne sürülmüştür. TPC2 ekspresyonu azaldığında veya devre dışı kaldığında, melanin üretiminde ve dolayısıyla melanozomal pH'da sonuçta bir yükselme olur ve TPC2 ekspresyonu arttığında daha az melanin üretimi olur.
TPC'ler ayrıca besinlerin durumunu belirlemede yapısal olarak aktif hale geldikleri için besin tespiti ile de ilgilenirler. Bu, hücrelerdeki oksijen, besin ve enerji seviyelerinin saptanmasıyla ilişkili olan ve böylece metabolizmanın düzenlenmesine yardımcı olan rapamisinin (mTOR'ler) memeli/mekanistik hedefleri ile TPC'ler arasındaki doğrudan iletişim ile yapılır. TPC'ler bu etkileşim yoluyla bu fizyolojik düzenlemede bu şekilde rol oynar.
TPC'ler sodyum ve kalsiyum iyonu iletkenliğini, intravasküler pH'ı ve kaçakçılığın uyarılabilirliğini düzenler. İkinci haberci nikotinik asit adenin dinükleotit fosfatın ( NAADP ), TPC'ler yoluyla bu asidik organellerden kalsiyum salınımına aracılık ettiği gösterilmiştir. TPC2'ler, bu TPC akımlarının NAADP antagonistleri tarafından bloke edilebildiği NAADP kapılı kalsiyum salma kanallarıdır. TCP2, SARS-CoV-2 virüsünün hücrelere girmesine izin veren endositozda kritik bir rol oynar .
Bu kanalların yıkılmasından, metabolik ve genel bulaşıcı hastalıklardan kansere kadar çeşitli rahatsızlıklar ortaya çıkabilir. TPC'lerin bu eksikliğinden kaynaklanan patolojik durumlar aşağıdaki bölümlerde ele alınmaktadır.
Membran kaçakçılığı
TPC'ler, membran kaçakçılığı yollarında ayrılmaz bir rol oynar . Endozomlarda ve lizozomlarda bölümlere ayrılırlar , özellikle endo-lizozomal füzyonlarda işlev görürler. TPC kaçakçılığı faaliyetinin korunduğu kaydedilmiştir; ancak TPC'leri değiştirmek, endositotik yoldaki taşımayı etkiler . TPC'lerin tam rolleri, hücre tipine ve bağlamına özeldir. Bu kanallar kalsiyum geçirgendir ve Ca2+ iyon kanalları olarak işlev görmelerini sağlar. TPC'ler için ikinci bir haberci olan NAADP tarafından uyarıldığında, sitozole kalsiyum salınır. Kalsiyum akışı, endozom ve lizozomlar arasındaki füzyonu düzenleyen ve insan ticareti olaylarına aracılık eden şeydir. TPC'lerin işlevi kaybolduğunda, alt tabakalar birikerek tıkanıklık oluşturur. TPC'lerin işlevi arttığında, lizozom genişler - bu mantıksal olarak endozomdan lizozoma artan füzyon olaylarıyla ilgilidir.
Parkinson hastalığı
Membran kaçakçılığı işlev bozukluğunun bir sonucu, Parkinson hastalığına yol açar . Mutasyonu LRRK2 enzim alter otofajiyi NAADP ve TPC2 bağlıdır. Mutasyon, NAADP ile uyarılmış sinyaller tarafından TPC2'den geçen Ca2+ akışının miktarını arttırır. Sinyalleşmedeki bu artış, artan füzyon hızı ve miktarı nedeniyle lizozomların boyutunda bir artışa yol açar. Bu nedenle lizozom, bileşenleri olması gerektiği gibi parçalayamaz. Bu yetersizlik hastalığın başlangıcı ile ilişkilidir. TPC2, Parkinson hastalığının gelişiminin bu özel mekanizmasında hayati bir rol oynadığından, potansiyel olarak terapötik bir hedef olabilir.
Ebola
Ebolavirus potansiyel ilaç hedefi olarak TPCS bırakarak konak hücre endositotik membran kaçakçılığı yararlanır. Ebolavirus aracılığıyla hücrelere girmek micropinocytosis endozomal veziküller ile. Endozomal vezikül içine girdikten sonra, Ebolavirüs membranı endozom lizozom ile kaynaşmadan önce viral içerikleri sitozole salmak için endozomal membran ile birleşir. Virüsün endozomlarda hareketi için Ca2+ gereklidir. NAADP, TPC'ler yoluyla kalsiyum salınımı yoluyla endozomların olgunlaşmasını düzenlediğinden, TPC'lerin normal işleyişi Ebolavirüsün kaçmasına izin verir. Bu nedenle, TPC'ler çalışmadığında, Ebola virüsü endozomun lizozomla birleşmesinden önce kaçamaz. Aslında, fareler tetradin ile tedavi edildiğinde enfeksiyon inhibe edilir. Bunun nedeni, tetradin'in TPC'nin kalsiyum salınımını bloke etmesi ve böylece Ebolavirüslerin lizozom tarafından parçalanacak olan endozomal ağ içinde bulunmasıdır.
Yağlı karaciğer
TPC'ler, NAFLD ve NASH gibi yağlı karaciğer hastalıklarına dahil edilmiştir . TPC2, endositotik membran kaçakçılığı için bir katyon kanalı olduğundan, TPC'ler, LDL moleküllerinin parçalanmaları ve geri dönüşümleri için kaçakçılığına katkıda bulunur . Bu öncelikle karaciğerde meydana gelir. Bozunma yolu, LDL'nin, TPC'lerin bulunduğu endozomlarda ve lizozomlarda sona ermesine neden olur. TPC mekanizması bir kez daha endozomların ve lizozomların (LDL'nin bozulduğu) füzyonu için kalsiyum akışına izin verir. TPC'ler mevcut olmadığında veya düzgün çalışmadığında, bozulma yolu kusurlu kaçakçılığa neden olur. Füzyon olayı olmadan LDL karaciğer hücrelerinde birikir. TPC'lerin kaybının, karaciğer hasarını gösteren yağlı karaciğerin bir ifadesi olan karaciğerin sarı renginin bir nedeni olduğu bulunmuştur.
Referanslar
Dış bağlantılar
- TPCN1+protein,+insan ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- AtTPC1+channel,+Arabidopsis ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- "CatSper ve İki Gözenekli Kanallar" . IUPHAR Reseptörler ve İyon Kanalları Veritabanı . Uluslararası Temel ve Klinik Farmakoloji Birliği.