sülfüril klorür - Sulfuryl chloride
|
|

|
|

|
|
| İsimler | |
|---|---|
|
IUPAC adı
kükürt klorür
|
|
| Diğer isimler
Sülfonil klorür
Sülfürik klorür Sülfür diklorür dioksit |
|
| tanımlayıcılar | |
|
3B model ( JSmol )
|
|
| chebi | |
| CHEMBL | |
| Kimyasal Örümcek | |
| ECHA Bilgi Kartı |
100.029.314 |
| AT Numarası | |
| 2256 | |
|
PubChem Müşteri Kimliği
|
|
| RTECS numarası | |
| ÜNİİ | |
| BM numarası | 1834 |
|
CompTox Panosu ( EPA )
|
|
|
|
|
|
| Özellikler | |
| SO 2 Cı 2 | |
| Molar kütle | 134.9698 g mol -1 |
| Dış görünüş | Keskin bir kokuya sahip renksiz sıvı. Ayaktayken sarılar. |
| Yoğunluk | 1,67 g cm -3 (20 °C) |
| Erime noktası | -54.1 °C (−65,4 °F; 219.1 K) |
| Kaynama noktası | 69,4 °C (156,9 °F; 342,5 K) |
| hidrolize eder | |
| çözünürlük | benzen , toluen , kloroform , CCl 4 , buzlu asetik asit ile karışabilir |
|
Kırılma indisi ( n D )
|
1.4437 (20 °C) |
| Tehlikeler | |
| GHS piktogramları |
 
|
| GHS Sinyal kelimesi | Tehlike |
| H314 , H335 | |
| P260 , P261 , P264 , P271 , P280 , +331 P301 + 330 , P303 + 353 + 361 , P304 + = 340 , P305 + 351 + 338 , P310 , P312 , P321 , başvurunuz P363 , P403 + 233 , P405 , P501 | |
| NFPA 704 (ateş elmas) | |
| Alevlenme noktası | yanıcı değil |
| Bağıntılı bileşikler | |
|
İlgili sülfüril halojenürler
|
kükürt florür |
|
Bağıntılı bileşikler
|
Tiyonil klorür Klorosülfonik asit Sülfürik asit |
|
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da). |
|
|
|
|
| Bilgi kutusu referansları | |
Sülfüril klorür , formül SO olan bir inorganik bileşiktir 2 CI 2 . En oda sıcaklığında , bir keskin kokulu renksiz bir sıvıdır. Hızlı hidrolizinden anlaşılacağı üzere kükürt klorür doğada bulunmaz .
Sülfüril klorür yaygın ile karıştırılır tionil klorür , SOClz 2 . Bu iki kükürt oksiklorürün özellikleri oldukça farklıdır: sülfüril klorür bir klor kaynağı iken tionil klorür bir klorür iyonu kaynağıdır . Alternatif bir IUPAC adı sülfüroil diklorürdür .
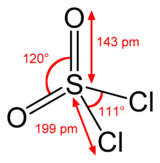
Yapı
Kükürt SO tetrahedral olan 2 Cl 2 ve oksidasyon durumu sülfür atomunun olduğu gibi, + 6 olan sülfürik asit .
sentez
SO 2 CI 2 reaksiyonu ile hazırlanır sülfür dioksit ve klor bir mevcudiyetinde katalizör gibi, aktive edilmiş karbon .
- SO 2 + Cl 2 → SO 2 Cl 2
Ürün fraksiyonel damıtma ile saflaştırılabilir .
Eski rotalar
Sülfüril klorür ilk olarak 1838'de Fransız kimyager Henri Victor Regnault tarafından hazırlandı .
Eski yollar, tionil klorürün oksidasyonunu içerir:
- SOC 2 + HgO → ClSSCl + HgCl 2 + SO 2 Cı 2
- 2 SOCl 2 + MnO 2 → SO 2 + MnCl 2 + SO 2 Cl 2
Reaksiyonlar
Sülfüril klorür su ile reaksiyona girerek hidrojen klorür gazı ve sülfürik asit açığa çıkarır :
- 2 H 2 O + SO 2 Cl 2 → 2 HCl + H 2 SO 4
SO 2 Cı 2 de olacaktır çürüyüp kaynama noktasının üzerinde, 30 ° C ila yaklaşık, ya da 100 ° C'nin üstünde ısıtıldığında.
Durduktan sonra, SO 2 Cı 2 için ayrıştığı sülfür dioksit ve klor eski örnek, hafif sarımsı bir renk verir.
SO 2 Cl 2 , kimyasallar (genellikle bir peroksit) veya ışıkla başlatılan alkan klorlamada bir klor kaynağı olarak kullanılabilir:
- CH 4 + SO 2 Cl 2 → CH 3 Cl + SO 2 + HCl
kullanır
Sülfüril klorür Cl bir kaynağı olarak kullanılan 2 . Dökülebilir bir sıvı olduğu için dağıtılması Cl 2'den daha uygun kabul edilir . Karboniller ve sülfoksitler gibi aktive edici sübstitüentlere bitişik C−H'nin C−Cl'ye dönüştürülmesinde bir reaktif olarak kullanılır . Aynı zamanda alkanları , alkenleri , alkinleri , aromatikleri , eterleri ( tetrahidrofuran gibi ) ve epoksitleri klorlar . Bu tür reaksiyonlar , AIBN gibi bir başlatıcı kullanılarak serbest radikal koşullar altında meydana gelir . Ayrıca tiyolleri veya disülfidleri ilgili sülfenil klorürlerine dönüştürmek için kullanılabilir , ancak bazı durumlarda sülfinil klorürler tiyollerden kaynaklanır. SO 2 Cı 2 de dönüştürebilir alkoller için alkil klorürler . Endüstride, sülfüril klorür en çok pestisit üretiminde kullanılır.
Kükürt klorür, çekmeyi önlemek için yünü işlemek için de kullanılabilir.
Önlemler
Sülfüril klorür toksiktir, aşındırıcıdır ve gözyaşı dökücü olarak işlev görür . Dimetil sülfoksit ve dimetilformamid gibi donör solventlerin yanı sıra suyla temas ettiğinde hidrojen klorürü serbest bırakır .
Ayrıca bakınız
Referanslar
- "Sülfüril klorür CAS No.: 7791-25-5" (PDF) . OECD SIDS . UNEP Yayınları. 2004. Orijinalinden (PDF) 2007-02-28 tarihinde arşivlendi.
- Maynard, GD (2001). "Sülfüril Klorür" . Organik Sentez için Reaktifler Ansiklopedisi . John Wiley ve Oğulları. doi : 10.1002/047084289X.rs140 . ISBN'si 978-0471936237.
daha fazla okuma
- Lautens, M.; Bouchain, G. (2002). "[4+3] Suda Sikloadisyon . 2,4- endo , endo -Dimetil-8-Oksabisiklo[3.2.1]okt-6-en-3-one sentezi ". Organik Sentezler . 79 : 251. doi : 10.15227/orgsyn.079.0251 .
- McKee, RH; Sals, CM (1924). "Sülfüril Klorür". Endüstri ve Mühendislik Kimyası . 16 (4): 351–353. doi : 10.1021/ie50172a008 .
- Musa, VN (2012). "Sülfüril Klorür: Klora Çok Yönlü Bir Alternatif". Avustralya Kimya Dergisi . 65 (1): 95–96. doi : 10.1071/CH11367 .
- Kuzey, HB (1910). "Tiyonil ve Sülfüril Klorürlerin Merkür ve Cıva Oksit Üzerindeki Etkisi" . Amerikan Kimya Derneği Dergisi . 32 (2): 184–187. doi : 10.1021/ja01920a004 .
- Kuzey, HB; Hageman, AG (1913). "Tiyonil Klorür ile Bazı Yeni Reaksiyonlar". Amerikan Kimya Derneği Dergisi . 35 (5): 543–546. doi : 10.1021/ja02194a004 .

