hidrojen iyonu - Hydrogen ion
Bir hidrojen atomu bir elektron kaybettiğinde veya kazandığında bir hidrojen iyonu oluşur . Pozitif yüklü bir hidrojen iyonu (veya proton) diğer parçacıklarla kolayca birleşebilir ve bu nedenle yalnızca gaz halindeyken veya neredeyse parçacıksız bir alanda olduğunda izole edilmiş olarak görülür. Sodyum iyonunun yaklaşık 2×10 10 katı olan son derece yüksek yük yoğunluğu nedeniyle , çıplak hidrojen iyonu, kolayca hidratlaştığı, yani hızlı bir şekilde bağlandığı için çözeltide serbestçe var olamaz. Hidrojen iyonu tarafından tavsiye edilen IUPAC herkes için genel bir terim olarak iyonları arasında , hidrojen ve izotopları . İyonun yüküne bağlı olarak iki farklı sınıf ayırt edilebilir: pozitif yüklü iyonlar ve negatif yüklü iyonlar.
Katyon (pozitif yüklü)
Bir hidrojen atomu, yükü +1 olan bir çekirdek ve tek bir elektrondan oluşur. Bu nedenle, mümkün olan tek pozitif yüklü iyon +1 yüke sahiptir. H + olarak not edilir .
Söz konusu izotopa bağlı olarak hidrojen katyonu farklı isimlere sahiptir:
- Hydron : herhangi bir hidrojen izotopunun (H + ) pozitif iyonuna atıfta bulunan genel isim
- Proton : 1 H + (yani protiumun katyonu )
- Döteron : 2 H + , D +
- Triton : 3 H + , T +
Ayrıca bu katyonların su ve bunların hidratları ile tepkimesi sonucu oluşan iyonlara da hidrojen iyonları denir:
- Hidronyum iyonu: H 3 O +
- Zundel katyonu : H 5 O 2 + ( Georg Zundel için adlandırılmıştır )
- Öz katyon : H 9 O 4 + (veya H 3 O + •3H 2 O) ( Manfred Eigen olarak adlandırılır )
Zundel katyonları ve Eigen katyonları, Grotthuss mekanizmasına göre proton difüzyonunda önemli bir rol oynar .
Asitlerle bağlantılı olarak, "hidrojen iyonları" tipik olarak hidronları ifade eder.
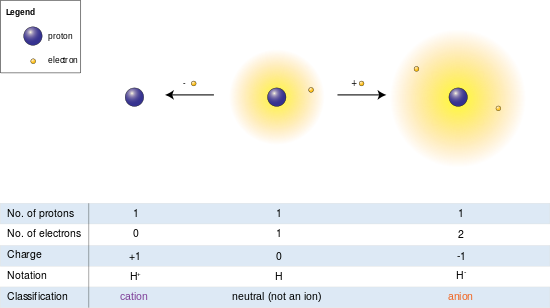
Soldaki resimde hidrojen atomu (ortada) tek bir proton ve tek bir elektron içerir. Elektronun çıkarılması bir katyon (solda) verirken, bir elektronun eklenmesi bir anyon (sağda) verir. Gevşek bir şekilde tutulan iki elektronlu bulutuyla hidrojen anyonu, nötr atomdan daha büyük bir yarıçapa sahiptir ve bu da katyonun çıplak protonundan çok daha büyüktür. Hidrojen, elektronu olmayan tek katyonu oluşturur, ancak (hidrojenden farklı olarak) hala bir veya daha fazla elektron tutan katyonlar bile, türetildikleri nötr atomlardan veya moleküllerden hala daha küçüktür.
Anyon (negatif yüklü)
Ek elektronlar elde edildiğinde hidrojen anyonları oluşur:
- Hidrür : herhangi bir hidrojen izotopunun (H − ) negatif iyonuna atıfta bulunan genel isim
- Protide: 1 H -
- Deuterid: 2 H - , D -
- Tritit: 3 H - , T -
kullanır
Hidrojen iyonları , fotosentezde ATP sentazını çalıştırır . Bu, hidrojen iyonları zar boyunca itildiğinde, tilakoid zarın içinde yüksek bir konsantrasyon ve sitoplazmada düşük bir konsantrasyon oluşturduğunda olur. Bununla birlikte, ozmoz nedeniyle H + , ATP sentaz yoluyla kendini zardan dışarı çıkmaya zorlayacaktır. Onların Kullanımı kinetik enerji kaçmak için, protonlar sırayla yaratacak ATP sentaz dönmeye olacak ATP . Bu, hücresel solunumda da olur, ancak konsantre zar bunun yerine mitokondrinin iç zarı olacaktır .
pH olarak ölçülen hidrojen iyonları konsantrasyonu, bir bileşiğin asidik veya bazik yapısından da sorumludur . Su molekülleri H + ve hidroksit anyonları oluşturmak üzere bölünür . Bu işleme suyun kendi kendine iyonlaşması denir .
okyanus asitlenmesi
Hidrojen iyonlarının konsantrasyonu ve pH ters orantılıdır; sulu bir çözeltide, artan bir hidrojen iyonu konsantrasyonu, düşük bir pH ve ardından asidik bir ürün verir. Tanım olarak asit, proton verebilen bir iyon veya moleküldür ve bir çözeltiye eklendiğinde su molekülleri (H 2 O) ile reaksiyona girerek bir hidronyum iyonu (H 3 O + ), suyun eşlenik asidini oluşturur. . Basit bir akıl yürütme için, hidrojen iyonu (H + ) genellikle hidronyum iyonunu kısaltmak için kullanılır.
Okyanus asitlenmesi, yüksek konsantrasyonlardaki hidrojen iyonlarının ve dünya okyanusları tarafından önemli miktarda karbon dioksit (CO 2 ) emiliminden kaynaklanan karbonat doygunluğunun doğrudan bir sonucudur . Okyanusun karbonat kimyasının endüstri öncesi durumu, pH dengesi de dahil olmak üzere, özellikle istikrarlı olmuştur. Sanayi devriminin ardından, yanan fosil yakıtların insan kaynaklı emisyonları, çimento üretimi ve arazi kullanımındaki değişiklikler, okyanusların atmosferden karbondioksit alımını %30 oranında artırdı. Okyanusta, bu sera gazının absorpsiyon kapasitesi atmosferdekinden 59 kat daha fazladır; okyanus , iklim düzenlemesinde önemli bir rol oynayarak gezegendeki en büyük karbon yutağı görevi görür . Karbon akışlarına ek olarak, atmosferden okyanusun derinliklerine karbonun doğal olarak tutulması süreci, biyolojik pompa ve çözünürlük pompası olmak üzere iki sistem tarafından kolaylaştırılır. Çözünürlük pompası CO aktaran bir fiziko-kimyasal bir süreçtir 2 hava-deniz arayüzü. Henry Kanunu göre, çözünmüş CO miktarı 2 sulu çözelti içinde CO kısmi basıncı ile doğru orantılıdır 2 atmosferde. Denge sağlamak için, CO yüksek atmosferik nispi bir basınç durumu 2 açar bir moleküler difüzyon ile bu gazın okyanus alışverişi artmıştır.
Yüzey sularında, çözünmüş atmosferik karbon dioksit (CO 2(aq) ) su molekülleri ile reaksiyona girerek zayıf bir diprotik asit olan karbonik asit (H 2 CO 3 ) oluşturur. Diprotik asitler, her molekülde iki iyonlaşabilir hidrojen atomundan oluşur. Sulu bir çözeltide, karbonik asidin kısmi ayrışması bir hidrojen protonu (H + ) ve bir bikarbonat iyonu (HCO 3 - ) açığa çıkarır ve ardından bikarbonat iyonu ek bir hidrojen protonu ve bir karbonat iyonuna (CO 3 2- ) ayrışır. . Bu inorganik karbon türlerinin çözünmesi ve ayrışması, hidrojen iyonlarının konsantrasyonunda bir artışa neden olur ve tersine ortam yüzeyi okyanus pH'ını düşürür. Karbonat tamponlama sistemi, çözünmüş inorganik karbon türlerini kimyasal dengede tutarak deniz suyunun asitliğini yönetir.
Kimyasal denklem, her iki yönde de reaksiyona girebilen reaktanlardan ve ürünlerden oluşur. Bir sisteme eklenen daha fazla reaktan, daha fazla ürün üretimi sağlar (kimyasal reaksiyon sağa kayar) ve daha fazla ürün eklenirse, kimyasal reaksiyonu sola kaydırarak ilave reaktanlar oluşur. Bu nedenle, bu modelde, başlangıç reaktanı olan karbon dioksitin yüksek konsantrasyonu, artan miktarda son ürün (H + ve CO 3 2- ) üretir , böylece pH'ı düşürür ve daha asidik bir çözelti oluşturur. Okyanusun doğal tamponlama sistemi, alkali bir karakter oluşturmak için karbonat iyonları ile reaksiyona giren serbest asit protonları tarafından üretilen daha fazla bikarbonat iyonu üreterek pH'daki değişime direnir. Bununla birlikte, atmosfer CO artan 2 sonuç okyanus asitleştirme daha yüksek katılım oranları elde tamponlama kapasitesi eşiğine aşabilir konsantrasyonları. Okyanusun karbonat kimyasındaki değişimler , deniz ekosistemleri üzerinde derin etkilere neden olan birçok element ve bileşik için okyanus biyojeokimyasal döngülerini manipüle etme potansiyeline sahiptir . Ayrıca, CO çözünürlüğü 2 sıcaklığa bağlıdır; yükseltilmiş yüzey suyu sıcaklıkları CO azaltmak 2 çözünürlüğü. CO atmosferik kısmi basıncı bir sürekli artış 2 , bir kaynak (CO olma potansiyel giderici olarak hareket okyanus dönüştürmek (okyanusun derinliklerine karbon dikey taşıma) 2 okyanus gaz çıkarma) olup, ayrıca, küresel sıcaklık artmaktadır.