Cornforth reaktifi - Cornforth reagent
|
|
|
|
| İsimler | |
|---|---|
| Diğer isimler
piridinyum dikromat
|
|
| tanımlayıcılar | |
|
3B model ( JSmol )
|
|
| chebi | |
| Kimyasal Örümcek | |
| ECHA Bilgi Kartı |
100.039.511 |
| AT Numarası | |
|
PubChem Müşteri Kimliği
|
|
| ÜNİİ | |
|
CompTox Panosu ( EPA )
|
|
|
|
|
|
| Özellikleri | |
| C 10 H 12 N 2 Cr 2 O 7 | |
| Molar kütle | 376.2 |
| Görünüm | turuncu ila kahverengi katı |
| Kaynama noktası | 145 - 147 °C (293 - 297 °F; 418 - 420 K) |
| suda çözünebilir | |
| Tehlikeler | |
| GHS piktogramları |
     
|
| GHS Sinyal kelimesi | Tehlike |
| H228 , H272 , H314 , H315 , H317 , H319 , H350 , H400 , H410 | |
| P201 , P202 , P210 , P220 , P221 , P240 , P241 , P260 , P261 , P264 , P272 , P273 , P280 , P281 , P301 + 331 330 , P302 + 352 , P303 + 353 361 , P304 + = 340 , P305 + 351 + 338 , P308 + 313 , P310 , P321 , P332 * 313 , P333 + 313 , P337 + 313 | |
|
Aksi belirtilmediği sürece, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da). |
|
|
|
|
| Bilgi kutusu referansları | |
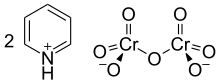
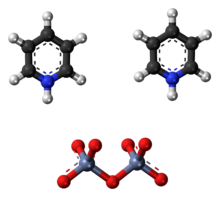
Cornforth reaktif ya da piridinyum dikromat (PDC), a, piridinyum tuzu dikromat ile kimyasal formül [Cı- 5 , H 5 = NH] 2 [Cr 2 O 7 ]. Bu bileşik, Avustralya İngiliz kimyager Sir almıştır John Warcup Cornforth 1962 Cornforth maddesi içinde tanıtıldı (d. 1917) dönüştüren bir güçlü oksitleyici madde olan primer ve sekonder alkoller için aldehitler ve ketonlar , sırasıyla. Kimyasal yapısı ve işlevleri açısından, piridinyum klorokromat ve Collins reaktifi gibi altı değerlikli krom oksitten yapılan diğer bileşiklerle yakından ilişkilidir . Toksisiteleri nedeniyle, bu reaktifler günümüzde nadiren kullanılmaktadır.
Sentez ve özellikleri
Cornforth reaktif konsantre bir sulu çözeltisinin yavaş yavaş ilave edilmesiyle hazırlanır krom trioksit ile , piridin . Reaksiyon, trioksitin suda tamamen çözülmesi ve çözeltinin buzla soğutulmasıyla önlenebilecek patlamaya neden olabilir. Ürün süzülür, asetonla yıkanır ve kurutularak portakal rengi bir toz elde edilir. Toz havada stabildir, özellikle higroskopik değildir ve kullanımını kolaylaştıran neredeyse nötr bir pH'a sahiptir; piridinyum katyonlarının varlığından dolayı sadece hafif asidiktir. Cornforth reaktifi su, dimetilformamid ve dimetil sülfoksit (DMSO) içinde kolaylıkla çözünür . Asetonda ve diklorometan gibi klorlu organik çözücülerde az çözünür ve süspansiyonlar oluşturur .
Uygulamalar
Cornforth reaktif birincil dönüştürme güçlü bir oksitleyicidir alkoller için aldehit ve ikincil alkoller için ketonlar bir çözelti veya süspansiyon olarak, her ikisi de. Bu uygulamadan ilk olarak 1969'da bahsedilmiş, ancak yalnızca 1979'da Corey ve Schmidt tarafından tamamen geliştirilmiştir. Çözücü olarak dimetilformamid kullanılarak doymuş birincil alkollerin PDC ile reaksiyonunun, aldehitlerden ziyade karboksilik asitlere oksidasyonla sonuçlandığını belirtmişlerdir . Bununla birlikte, alilik ve benzilik birincil alkollerde karboksilik asitlere oksidasyon olmaz.
Oksidasyon genellikle çevre koşullarında, neredeyse nötr pH koşullarında, dimetilformamid veya diklorometan veya bunların karışımı içinde gerçekleştirilir. Çözücü seçimi veya oranları reaksiyon hızını etkiler; özellikle, daha yüksek dimetilformamid içeriği, daha güçlü oksidasyona neden olur. Bazı alkoller için yavaş oksidasyon hızı, moleküler elekler , organik asitler veya asetik anhidrit veya bunların kombinasyonlarının eklenmesiyle hızlandırılabilir . Moleküler eleklerle hızlandırma, gözenek çapları yaklaşık 0,3 nm olduğunda en iyi sonucu verir ve görünüşe göre su emme yetenekleriyle ilgisizdir. Organik asitler arasında asetik asit , piridinyum trifloroasetat veya piridinyum tosilat eklenebilir, ilki en etkili ve çıkarılması en kolay olanıdır. Elde edilen ivme dikkat çekicidir, ancak reaksiyon kaçınılmaz olarak nötrden (pH) asidik hale gelir. Şeker ve nükleosit kimyasında kullanılan asetik anhidrit ile kıyaslanabilir bir ivme elde edilir . Reaksiyonun hızlanması sadece katkı maddelerine değil aynı zamanda biçimlerine de bağlıdır, bu nedenle tüm reaktifler kuru ve taze hazırlanmış olarak tercih edilir ve PDC ve moleküler elekler ince öğütülmelidir. Hızlandırıcıların dezavantajı, aynı anda birkaç oksidasyon yolunu destekleyebilmeleri ve böylece reaksiyonun seçiciliğini azaltabilmeleridir.
Kimyasal yapısı ve işlevleri bakımından Cornforth reaktifi, piridinyum klorokromat [PyH][CrO 3 Cl] gibi altı değerli krom oksitin diğer piridinyum tuzları ve diklorometan içindeki Collins reaktifi , CrO 3 ·2Py gibi piridin kompleksleri ile yakından ilişkilidir. ve piridin içinde Sarret reaktifi , CrO 3 ·2Py.
Güvenlik sorunları
Cornforth reaktifi sudaki yaşam için çok toksiktir ve büyük miktarlarda salındığında çevreye uzun vadeli zarar verebilir. Cildi ve mukoza zarlarını tahriş eder ve alerjik reaksiyonlara neden olabilir; kanserojendir. İzin verilen maksimum konsantrasyon • m mg 0,01 ile 0,1 değişir -3 havada ülkeye bağlı olarak. Altı değerlikli krom içerdiğinden , kanserojen olduğundan şüphelenilmektedir ve güçlü bir oksitleyici olarak piridinyum dikromat, yangınları teşvik ederek karbon monoksit , karbon dioksit ve toksik metal dumanı yayar. Yangın su veya CO 2 ile söndürülebilir .

