Otomatik yama kelepçesi - Automated patch clamp
Otomatik yama kenetleme , tek tek hücrelerin elektriksel aktivitesini ölçmek için bir yöntem olarak manuel yama kenetlemenin yerini almaya başlıyor . Hücre kültüründe ve in vivo olarak hücrelerden yama kelepçesi kayıtlarını otomatikleştirmek için farklı teknikler kullanılır . Bu çalışma, 1990'ların sonlarından beri araştırma laboratuvarları ve yama sıkıştırmanın karmaşıklığını ve maliyetini manuel olarak azaltmaya çalışan şirketler tarafından devam etmektedir. Yama kenetleme uzun süre bir sanat formu olarak kabul edildi ve özellikle in vivo olarak hala çok zaman alıcı ve sıkıcı. Otomasyon teknikleri , tek hücrelerden kaliteli elektrofizyoloji kayıtları elde etmede kullanıcı hatasını ve değişkenliği azaltmaya çalışır .
Manuel yama kelepçesi
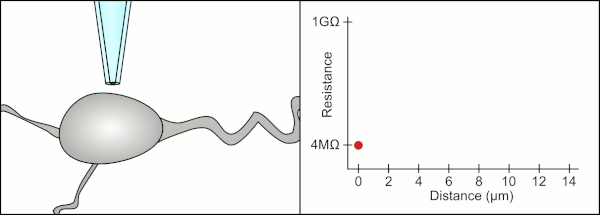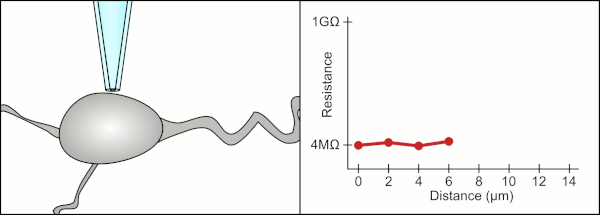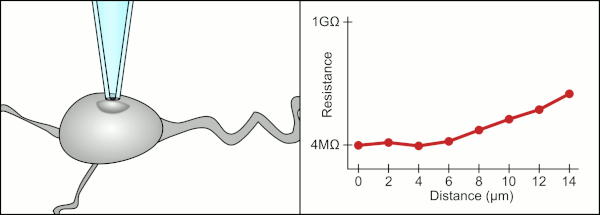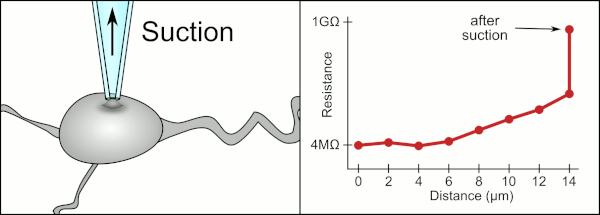
Cam pipetler kullanarak kelepçeyi yamalamak için geleneksel manuel yöntem, Erwin Neher ve Bert Sakmann tarafından geliştirildi ve çok yetenekli bir teknisyen gerektirdi. Teknisyen cam pipeti bir hücrenin yanına yerleştirir ve pipet ile hücre zarı arasında elektriksel bir yalıtım oluşturmak için uygun emme uygular. Bu conta, pipet ucu ile hücre zarı arasında herhangi bir akım sızmasını engelleyerek kaliteli bir kayıt sağlar. Bu mühür, hücre zarının kimyasal olarak pipetin ucuna bağlanmasıyla gerçekleşir, böylece pipetin içi sadece hücrenin sitoplazmasına bağlanır . Bu membran-cam bağlantısına veya contasına "gigaseal" denir.
Teknisyen, geleneksel olarak, hücreyi kapatmak için gereken kesin basınçları sağlamak için ağızlarını kullandı. Teknisyen, basıncı kontrol etmenin yanı sıra, pipeti hücreden tam olarak doğru mesafede konumlandırmalı, böylece zarın hücre ile sızdırmazlığını sağlamalıdır. Bir mikromanipülatör kullanarak , teknisyen pipetin içindeki sıvı ile çevreleyen sıvı arasındaki elektrik direncinde bir değişiklik görene kadar pipet hücreye doğru hareket ettirilir (animasyona bakın). Bu, bir teknisyenin hücrelerden güvenilir bir şekilde kayıt yapabilmesi için genellikle 3-12 aylık bir eğitim gerektirir. Teknisyen aslında birkaç sistemi (hareket, basınç ve elektrik sinyalleri) aynı anda izlemeye ve manipüle etmeye çalışan bir dengeleme eylemi gerçekleştiriyor. İşlemin her bir bölümü doğru ve doğru zamanlama ile gerçekleştirilmedikçe, conta düzgün şekilde oluşmayacak ve teknisyenin pipeti değiştirmesi ve baştan başlaması gerekecektir.
Bu zorluklar, bir teknisyenin elde edebileceği kayıt sayısını azaltır ve maliyeti önemli ölçüde artırır. Otomasyon, manuel yama sıkıştırmanın zamanını, karmaşıklığını ve maliyetini azaltmayı amaçlar.
Otomasyon sistemleri
Otomasyon tekniği, hücrelerin çevre ortamına bağlı olarak değişir. İn vivo hücreler için bu tipik olarak hücrelerin beyinde olduğu ve diğer hücrelerle çevrili olduğu anlamına gelir. Bu ortam ayrıca 1-2μm çapındaki pipet ucunu tıkayarak bir gigaseal oluşturmayı zorlaştıran kan damarları , dendritler , aksonlar ve glial hücreler içerir. Burada, pipet ucundaki basıncın ve konumun hassas kontrolü, yukarıda tartışıldığı gibi tıkanmayı önlemede ve bir hücrenin pipetin ucuna yakın olup olmadığını tespit etmede büyük rol oynar.
Hücreler in vitro bir sıvı içinde süspanse edilebilir, bir kültür kabına yapışabilir veya hayvandan çıkarılan bir doku parçasının parçası olarak kalabilir. Bu ortamlar tipik olarak bir hayvanın kalp atışı veya nefes alması nedeniyle dokunun hareketini telafi etmek zorunda değildir. Süspansiyon halindeki hücreler durumunda, pipet tamamen gigasealler oluşturabilen ve elektriksel aktiviteyi ölçebilen deliklere sahip bir mikroçip ile değiştirilir. Hücreler ve pipet, teknisyenin ilgilenilen hücre dışında her şeyden kaçınmasına yardımcı olan bir mikroskop aracılığıyla görülebildiğinden, kültür kaplarındaki hücreler veya dokular için tıkanma da daha az sorunludur.
Bu otomatik sistemlerin her biri birkaç görevi yerine getirmelidir. Hücreyi bir pipetin ucuna veya 1-2μm delikli başka bir cihaza yerleştirmeli, delikteki basıncı kontrol etmeli ve hücre içindeki voltajı kontrol etmelidir.
canlılarda
İn vivo yama kenetlemenin bir örneği, Kodandaramaiah ve diğerleri tarafından gösterilmiştir. Bu durumda basınç kontrolü, daha önce bir teknisyen tarafından sağlanan üç basıncı (yüksek basınç 800-1000 mbar, düşük basınç 20-30 mbar ve küçük bir vakum 15-150 mbar) sağlamak için bir dizi elektronik valf ve elektronik basınç düzenleyiciden oluşuyordu. Üç basınç ve atmosfer basıncı arasında geçiş yapan üç elektronik valf. Pipetin tıkanmasını önlemek için yüksek basınç kullanıldı, hücreler aranırken düşük basınç kullanıldı ve gigasealing işlemine yardımcı olmak için vakum kullanıldı. Bunların hepsi, pipetin ucundaki direnç değiştikçe basınçlar arasından seçim yapmak için bir bilgisayar tarafından kontrol edildi.
Bu durumda manuel pozisyon kontrolü , pipeti bir hücre ile temas edene kadar 2-3 um'lik adımlarla dokuya hareket ettiren bilgisayar kontrollü bir piezoelektrik mikromanipülatör ile değiştirildi . Bu hassas kontrol, manuel konumlandırmadan çok daha doğru ve tekrarlanabilirdir ve bir operatör gerektirmez.
Bilgisayar ayrıca, pipet hücre ile temas ettiğinde elektrik direncindeki değişimi hesaplar ve izler. Pipetin ucundan çıkan veya hücre zarı tarafından bloke edilen pipete kare dalga şeklinde bir voltaj sinyali gönderir. Membran onu bloke ettiğinde, bilgisayar pipetin hareketini durdurur ve gigaseal oluşturmak için emme uygular. Bu otomasyon, bir teknisyenin yapması gereken karar verme sürecini ortadan kaldırır ve bir teknisyenin aksine, bilgisayar bu görevleri yorulmadan ve daha hassas bir şekilde gerçekleştirebilir.
Bu adımların tümü, manuel yama kenetleme ile aynı mantıksal sırada gerçekleştirilir, ancak gerçekleştirilmesi için kapsamlı bir eğitim gerektirmez ve tamamen bilgisayar tarafından kontrol edilir. Bu, yama kelepçesi kayıtları elde etmek için gereken masrafı azaltır ve canlı beyinde kaydın tekrarlanabilirliğini ve sağlamlığını arttırır.
süspansiyon halinde
Süspansiyon kültürlerinde hücrelerin yama klemplenmesi için birçok sistem türü geliştirilmiştir. Bir sistem, yama kelepçesi kayıtları elde etmek için geleneksel bir pipet ve damlacık süspansiyon kültüründeki hücreleri kullanır (şekle bakın). Bu, bir cam kılcal damarı ısıtan ve yama klemplemede kullanılan konik ucu oluşturmak için onu uzunlamasına çeken geleneksel pipet üretim sistemleri kullanmanın ek avantajına sahiptir.
Süspansiyon kültürleri için daha yaygın otomasyon sistemleri, gigaseal oluşturmak ve tek hücrelerden kayıt yapmak için pipetler yerine düzlemsel bir substratta küçük (1-2μm) deliklere sahip mikroçipler kullanır. Yama yongaları , yarı iletken endüstrisi tarafından geliştirilen mikrofabrikasyon teknolojilerinin iyileştirilmesinin bir sonucu olarak 2000'li yılların başında geliştirildi . Çipler tipik olarak silikon , cam , PDMS , polimitten yapılır . Yama çip sistemleri genellikle daha karmaşık ve pahalıdır ancak paralel ve eller serbest çalışma ek avantajına sahiptir.
Normalde, nöronlar süspansiyon kültürlerinde büyümezler, ancak diğer hücre tipleri büyüyebilir. Bazıları, ilgilenilen zar iyon kanallarını oluşturmak için genlerle transfekte edilebilir . Bu, normalde elektriksel aktiviteye sahip olmayan bir hücrenin zarında iyonik akımlar oluşturacak iyon kanalları oluşturabileceği anlamına gelir. Süspansiyon kültürlerinde hücreler birbirinden ayrıldığından, tek bir hücredeki iyonik akımlar hassas bir şekilde ölçülebilir. Bu, araştırmacıların, genellikle sinir ağlarında olduğu gibi, diğer hücrelerden gelen akımlar olmadan daha kontrollü ortamlarda iyon kanalı davranışını incelemesine olanak tanır. Bu, özellikle hedefin spesifik bir protein olduğu ilaç tarama çalışmalarında faydalıdır. Hücreleri süspansiyon halinde işlemek, kültürde veya in vivo hücrelerde işlem yapmaktan çok daha kolay olduğu için, yama klemp kayıtları bu şekilde çok daha hızlı ve daha güvenilir bir şekilde elde edilebilir, bu da üretkenliği artırır ve binlerce bileşiğin taranmasını mümkün kılar.
Yapışkan bir şekilde kültürlenen kök hücrelerden türetilen nöronlar , süspansiyon haline getirilebilir ve düzlemsel yama kıskaç cihazlarında başarıyla kullanılmıştır. Gibi iyon kanalları voltaj bağımlı sodyum kanalının , voltaj kapılı potasyum kanal ve iyonotropik ligand-kapılı iyon kanallarının ligand tarafından açılan GABA otomatik ve manuel yama kelepçe kullanılarak bu hücrelerden kaydedildi.
Kültürde
Kültürlenmiş hücrelerin veya beyin dokusu dilimlerinin otomatik yama klemplenmesi için birçok in vitro yöntem vardır.
Biri, yukarıda tartışılanlar gibi bir yama çipi ile birlikte kültürlenmiş hücrelerin, büyüdükçe gigaseal'in oluştuğu deliklere göç etmesine neden olan yüzey işlemleri kullanır. Nöronların kültür içinde büyümesine izin vererek, beyindeki gibi, süspansiyon halinde izole edilmiş hücrelerden daha çok doğal dokulara benzeyen ağları kendiliğinden oluştururlar.
Başka bir yöntemde, hücreler bir hayvandan çıkarılır ve poliimid ve PDMS yama çipleri ile kendiliğinden gigasealler oluşturdukları için 2-4 saat boyunca yama çipinde kültürlenir .
Başka bir teknik, kültürlerde yama kenetleme hücrelerinin konumlandırılmasını otomatikleştirir. Bir kültür çanağı içindeki bir yüzeyi taramak için hassas, piezo-etkin bir aşamada bir nanopipet kullanır. Tarama yaparken, pipetin ucu ile altındaki yüzey veya hücreler arasında yukarı ve aşağı hareket ettirerek sabit bir elektrik kapasitansı sağlar. (Hücreye yaklaştıkça kapasitans artar, bu nedenle aktüatör pipeti uzaklaştırır ve bunun tersi de geçerlidir.) Bu, kültür kabı içindeki yüzeyin kesin bir topografik haritasını verir. Hücreler eşlendikten sonra, bilgisayar pipeti seçilen bir hücreye taşır ve onunla bir gigaseal oluşturmak için alçaltır.
Başka bir teknik, hücrelerle dikkatli bir şekilde temas kurma işini basitçe otomatikleştirir. Operatör numunenin üzerine bir pipet yerleştirir ve ardından otomatik yazılımın devreye girmesine izin vererek pipeti indirir ve bir hücre ile temas ettiğinde pipet üzerindeki direnç artışını tespit etmeye çalışır. Bu noktada süreç sona erer ve bir teknisyen gigaseal'i manuel olarak oluşturur.
Geliştirme ve kabul
Patch-kelepçe otomasyon enstrümantasyonu 2003 yılında ticari olarak temin edilebilir hale geldi. Başlangıçtaki yüksek maliyeti nedeniyle, bu yaklaşık 20 yıllık teknolojinin başlangıçta biyoteknoloji ve ilaç endüstrilerine hizmet etmesi amaçlandı, ancak son yıllarda akademi ve kar amacı gütmeyen ortamlarda varlığı artıyor, artan kanıtlanmış teknik güvenilirliği ve maliyetteki göreceli erişilebilirliği göz önüne alındığında. Giderek artan sayıda üniversite ve diğer akademik kurum, diğer ilişkili veya tamamlayıcı teknolojiler ve yöntemlerle bağlantılı ve birlikte var olan yama-kelepçeli otomatik cihazlarla donatılmış laboratuvarlara ve temel tesislere sahiptir. Otomasyon yama-kelepçe elektrofizyolojisinin kabulü ve tanınması, bu devrim niteliğindeki yeni teknolojiyle elde edilen sonuçlarla yayınlanan bilimsel literatürün katlanarak büyümesine yansımaktadır.


