Proteinlerin nükleer manyetik rezonans spektroskopisi - Nuclear magnetic resonance spectroscopy of proteins
Proteinlerin Nükleer manyetik rezonans spektroskopisi (genellikle kısaltılan protein NMR ) bir çalışma alanı olan bir yapısal biyoloji içinde NMR spektroskopisi yapısı ve dinamikleri hakkında bilgi elde etmek için kullanılır proteinleri ve aynı zamanda nükleik asitler ve bunların kompleksleri. Alan öncülüğünü Richard R. Ernst ve Kurt Wüthrich de ETH ve tarafından Reklam Bax , Marius Clore en Angela Gronenborn NIH ve Gerhard Wagner de Harvard Üniversitesi diğerleri arasında. NMR spektroskopisi ile yapı tayini, genellikle, her biri ayrı bir dizi çok özel teknik kullanan birkaç aşamadan oluşur. Numune hazırlanır, ölçümler yapılır, yorumlayıcı yaklaşımlar uygulanır ve bir yapı hesaplanır ve doğrulanır.
NMR , atomun merkezi çekirdeğinin (" çekirdek ") kuantum-mekanik özelliklerini içerir . Bu özellikler yerel moleküler ortama bağlıdır ve ölçümleri, atomların kimyasal olarak nasıl bağlandığının, uzayda ne kadar yakın olduklarının ve birbirlerine göre ne kadar hızlı hareket ettiklerinin bir haritasını sağlar. Bu özellikler temelde daha tanıdık manyetik rezonans görüntülemede (MRI) kullanılanlarla aynıdır , ancak moleküler uygulamalar, ölçeğin milimetreden (radyologların ilgisini çeken) nanometreye (bağlı atomlar ) değişmesine uygun, biraz farklı bir yaklaşım kullanır. tipik olarak bir nanometrenin bir kısmı), bir milyonun bir faktörü. Bu ölçek değişikliği, uzun vadeli ölçüm için çok daha yüksek algılama hassasiyeti ve kararlılık gerektirir. MRG'nin aksine, yapısal biyoloji çalışmaları doğrudan bir görüntü oluşturmaz, üç boyutlu moleküler modeller oluşturmak için karmaşık bilgisayar hesaplamalarına dayanır.
Şu anda numunelerin çoğu suda bir çözelti içinde inceleniyor, ancak katı numunelerle de çalışmak için yöntemler geliştiriliyor . Veri toplama, numuneyi güçlü bir mıknatısın içine yerleştirmeye, numune üzerinden radyo frekansı sinyalleri göndermeye ve bu sinyallerin emilimini ölçmeye dayanır. Protein içindeki atomların ortamına bağlı olarak, tek tek atomların çekirdekleri farklı radyo sinyalleri frekanslarını emecektir. Ayrıca, farklı çekirdeklerin absorpsiyon sinyalleri, bitişik çekirdekler tarafından bozulabilir. Bu bilgi, çekirdekler arasındaki mesafeyi belirlemek için kullanılabilir. Bu mesafeler, proteinin genel yapısını belirlemek için kullanılabilir.
Tipik bir çalışma, muhtemelen etkileşimin normal biyolojisini (" kimyasal biyoloji ") araştırmak için kullanılabilecek küçük moleküller geliştirmek veya farmasötik kullanım için olası ipuçları sağlamak ( ilaç geliştirme ) amacıyla iki proteinin birbiriyle nasıl etkileşime girdiğini içerebilir. ). Sıklıkla, etkileşime giren protein çifti, insan genetiği çalışmaları ile tanımlanmış olabilir, bu da etkileşimin olumsuz mutasyonlar tarafından bozulabileceğini veya meyve sineği, maya gibi bir "model" organizmanın normal biyolojisinde önemli bir rol oynayabileceğini gösterir. , solucan C. elegans veya fareler. Bir numune hazırlamak için, tipik olarak bakteriyel fermantasyon yoluyla miktarlar yapmak için moleküler biyoloji yöntemleri kullanılır . Bu aynı zamanda , izotopların farklı davrandığı ve örtüşen NMR sinyallerinin tanımlanması için yöntemler sağladığı için arzu edilen molekülün izotopik bileşiminin değiştirilmesine de izin verir .
örnek hazırlama

Protein nükleer manyetik rezonansı, yüksek oranda saflaştırılmış proteinin sulu numuneleri üzerinde gerçekleştirilir . Genellikle numune, 0,1 – 3 milimolar aralığında bir protein konsantrasyonuna sahip 300 ila 600 mikrolitre arasında oluşur . Protein kaynağı ya doğal olabilir ya da genetik mühendisliği yoluyla rekombinant DNA teknikleri kullanılarak bir üretim sisteminde üretilebilir . Rekombinant olarak eksprese edilen proteinlerin yeterli miktarda üretilmesi genellikle daha kolaydır ve bu yöntem izotopik etiketlemeyi mümkün kılar.
Saflaştırılan protein genellikle bir tampon çözeltisi içinde çözülür ve arzu edilen çözücü koşullarına ayarlanır. NMR numunesi, ince duvarlı bir cam tüp içinde hazırlanır .
Veri toplama
Protein NMR, protein hakkında bilgi elde etmek için çok boyutlu nükleer manyetik rezonans deneylerini kullanır. İdeal olarak, moleküldeki her bir farklı çekirdek, farklı bir elektronik ortam yaşar ve bu nedenle, tanınabileceği farklı bir kimyasal kaymaya sahiptir . Bununla birlikte, proteinler gibi büyük moleküllerde, rezonansların sayısı tipik olarak birkaç bin olabilir ve tek boyutlu bir spektrum kaçınılmaz olarak tesadüfi örtüşmelere sahiptir. Bu nedenle, farklı çekirdeklerin frekanslarını ilişkilendiren çok boyutlu deneyler yapılır. Ek boyutlar örtüşme olasılığını azaltır ve molekülün belirli bir parçası içindeki çekirdeklerden gelen sinyalleri ilişkilendirdikleri için daha büyük bir bilgi içeriğine sahiptir. Manyetizasyon, elektromanyetik ( radyofrekans ) enerji darbeleri kullanılarak numuneye ve gecikmeler kullanılarak çekirdekler arasında aktarılır ; süreç, sözde darbe dizileri ile tanımlanır . Darbe dizileri, deneycinin çekirdekler arasındaki belirli bağlantı türlerini araştırmasını ve seçmesini sağlar. Proteinler üzerinde kullanılan nükleer manyetik rezonans deneyleri, iki ana kategoriye ayrılır - biri manyetizasyonun kimyasal bağlar yoluyla aktarıldığı ve diğeri, bağlanma yapısından bağımsız olarak aktarımın uzay yoluyla olduğu. İlk kategori, belirli bir çekirdeğe farklı kimyasal kaymaları atamak için kullanılır ve ikincisi, öncelikle yapı hesaplamasında ve etiketlenmemiş protein atamasında kullanılan mesafe sınırlamalarını oluşturmak için kullanılır.
Numunenin konsantrasyonuna, spektrometrenin manyetik alanına ve deneyin tipine bağlı olarak, bir protein numunesi üzerinde tek bir çok boyutlu nükleer manyetik rezonans deneyinin uygun sinyal-gürültü oranını elde etmesi saatler hatta birkaç gün sürebilir. sinyal ortalama alma yoluyla ve deneyin çeşitli boyutları aracılığıyla yeterli manyetizasyon aktarımı evrimine izin vermek için. Diğer şeyler eşit olduğunda, yüksek boyutlu deneyler, düşük boyutlu deneylerden daha uzun sürecektir.
Tipik olarak, bir izotop etiketli protein ile ölçülecek ilk deney, 2D heteronükleer tek kuantum korelasyon (HSQC) spektrumudur, burada "heteronükleer", 1H dışındaki çekirdekleri ifade eder. Teoride, heteronükleer tek kuantum korelasyonu, bir heteronükleusa bağlı her H için bir tepe noktasına sahiptir. Bu nedenle, 15N-HSQC olarak, bir ile 15 N etiketli protein, bir sinyal hariç geri kemikte her azot atomuna için beklenen prolin bağlı omurgasında siklik doğaya hiç amid hidrojene sahip,. Ek 15N-HSQC sinyalleri, yan zincirinde (W, N, Q, R, H, K) bir nitrojen-hidrojen bağı bulunan her tortu tarafından sağlanır. 15N-HSQC'ye genellikle bir proteinin parmak izi denir, çünkü her proteinin benzersiz bir sinyal konumu modeli vardır. 15N-HSQC'nin analizi, araştırmacıların beklenen sayıda tepe noktasının mevcut olup olmadığını değerlendirmelerine ve böylece çoklu konformasyonlardan veya numune heterojenliğinden kaynaklanan olası sorunları belirlemelerine olanak tanır . Nispeten hızlı heteronükleer tek kuantum korelasyon deneyi, sonraki daha uzun, daha pahalı ve daha ayrıntılı deneyler yapmanın fizibilitesini belirlemeye yardımcı olur. Tek başına heteronükleer tek kuantum korelasyonundan belirli atomlara tepe noktaları atamak mümkün değildir.
rezonans ataması
Nükleer manyetik rezonans verilerini analiz etmek için protein için bir rezonans ataması almak, yani hangi kimyasal kaymanın hangi atoma karşılık geldiğini bulmak önemlidir . Bu, tipik olarak , birkaç farklı NMR deneyi türünden elde edilen bilgileri kullanarak sıralı yürüyüşle elde edilir . Atama deneylerinin çoğu karbon-13 ve nitrojen-15'e bağlı olduğundan, kesin prosedür proteinin izotopik olarak etiketlenip etiketlenmediğine bağlıdır.
Homonükleer nükleer manyetik rezonans
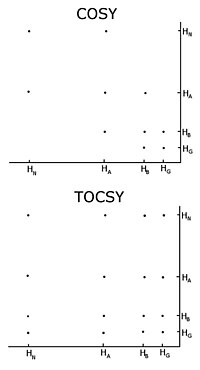
Etiketlenmemiş protein ile genel prosedür, çeşitli türleri geleneksel korelasyon spektroskopisi, toplam korelasyon spektroskopisi (TOCSY) ve nükleer Aşırı Habur etkisi spektroskopisi (NOESY) içeren korelasyon spektroskopisi (COSY) aracılığıyla bir dizi iki boyutlu homonükleer nükleer manyetik rezonans deneylerini kaydetmektir. . İki boyutlu bir nükleer manyetik rezonans deneyi, iki boyutlu bir spektrum üretir. Her iki eksenin birimleri de kimyasal kaymalardır. COSY ve TOCSY, mıknatıslanmayı bitişik protonlar arasındaki kimyasal bağlar aracılığıyla aktarır. Konvansiyonel korelasyon spektroskopisi deneyi, yalnızca bitişik atomlar üzerindeki protonlar arasındaki manyetizasyonu aktarabilirken, toplam korelasyon spektroskopisi deneyinde, protonlar manyetizasyonu iletebilir, bu nedenle bitişik atomlar tarafından bağlanan tüm protonlar arasında aktarılır. Böylece geleneksel bir korelasyon spektroskopisinde, bir alfa protonu manyetizasyonu beta protonlarına aktarır, beta protonları varsa alfa ve gama protonlarına aktarır, daha sonra gama protonu beta ve delta protonlarına aktarır ve süreç devam eder. . Toplam korelasyon spektroskopisinde, alfa ve diğer tüm protonlar, sürekli bir proton zinciri ile bağlanırlarsa, manyetizasyonu beta, gama, delta, epsilona aktarabilirler. Sürekli proton zinciri, tek tek amino asitlerin yan zinciridir . Bu nedenle, bu iki deney peptid proton kimyasal kayma, alfa proton ve her tüm proton rezonanslarının bir liste oluşturmak olduğu, sözde eğirme sistemleri kurmak için kullanılan tortu ‘in yan zincir. Spin sistemindeki hangi kimyasal kaymaların hangi çekirdeğe karşılık geldiği, geleneksel korelasyon spektroskopisi bağlantılarıyla ve farklı proton türlerinin karakteristik kimyasal kaymalara sahip olduğu gerçeğiyle belirlenir. Farklı döndürme sistemlerini sıralı bir sırayla bağlamak için nükleer Overhauser etkisi spektroskopisi deneyi kullanılmalıdır. Bu deney, manyetizasyonu uzayda aktardığından, aynı spin sisteminde olup olmadıklarına bakılmaksızın, uzayda yakın olan tüm protonlar için çapraz tepeler gösterecektir. Komşu artıklar doğal olarak uzayda yakındır, bu nedenle atamalar diğer döndürme sistemleriyle NOESY'deki tepe noktaları tarafından yapılabilir.
Homonükleer nükleer manyetik rezonans kullanan önemli bir problem, tepe noktaları arasındaki örtüşmedir. Bu, farklı protonlar aynı veya çok benzer kimyasal kaymalara sahip olduğunda meydana gelir. Protein büyüdükçe bu problem daha da büyür, bu nedenle homonükleer nükleer manyetik rezonans genellikle küçük proteinler veya peptitlerle sınırlıdır.
Azot-15 nükleer manyetik rezonans
En sık yapılan 15N deney 1 H- 15 K HSQC. Deney oldukça hassastır ve bu nedenle nispeten hızlı bir şekilde gerçekleştirilebilir. Genellikle bir proteinin NMR kullanılarak yapı tayini için uygunluğunu kontrol etmek ve numune koşullarının optimizasyonu için kullanılır. Proteinin çözelti yapısının belirlenmesi için kullanılan standart deney takımlarından biridir. HSQC, 15 N-TOCSY-HSQC ve 15 N-NOESY-HSQC gibi üç ve dört boyutlu NMR deneylerine daha da genişletilebilir .

Karbon-13 ve nitrojen-15 nükleer manyetik rezonans
Protein karbon-13 ve nitrojen-15 ile etiketlendiğinde, manyetizasyonu peptit bağı üzerinden aktaran üçlü rezonans deneylerini kaydetmek ve böylece bağlar yoluyla farklı döndürme sistemlerini bağlamak mümkündür. Bu genellikle aşağıdaki deneylerden bazıları kullanılarak yapılır, HNCO , HN(CA)CO }, HNCA , HN(CO)CA , HNCACB ve CBCA (CO)NH . Altı deneyler oluşur 1 H- 15 , bir karbon boyut ile genişletilmiş (a HSQC spektrumuna benzeri), N düzlemi. İçinde HN (CA), CO , her biri H , N düzlemi tortu da sırayla önceki birinden karbonil karbondan tepeleri içerir. HNCO , sadece önceki kalıntıdan karbonil karbon kimyasal kayma içerir, ancak çok daha hassastır HN (CA) CO . Bu deneyler, her izin 1 H- 15 N maximum önceki karbonil karbonuna bağlı olması ve ardışık atanması daha sonra her bir eğirme sisteminin kendi önceki karbonlu vardiya eşleştirerek gerçekleştirilebilir. HNCA ve HN (C = O), CA , sadece alfa karbonu (Cı ile benzer şekilde çalışır, α ) yerine karboniller ve HNCACB ve CBCA (CO) NH alfa karbon ve beta karbon hem de içerir (Cı- β ). Karbon boyutundaki örtüşmeyi çözmek için genellikle bu deneylerden birkaçı gereklidir. Bu prosedür, tahvil transferine dayalı olduğu için genellikle NOESY tabanlı yöntemden daha az belirsizdir. NOESY tabanlı yöntemlerde, uzayda yakın olan ancak ardışık kalıntılara ait olmayan atomlara karşılık gelen ek tepeler ortaya çıkacak ve atama sürecini karıştıracaktır. İlk sıralı rezonans tanımlanarak, C den atama uzanan genellikle mümkündür a ve C p gibi temelde ilave bir karbon boyutta çözülmüş bir TOCSY deney HCCH-TOCSY, gibi deneyler kullanılarak yan zincir geri kalanına.
Kısıtlama üretimi
Yapı hesaplarının yapılabilmesi için deneysel olarak belirlenmiş bir dizi kısıtlamanın oluşturulması gerekmektedir. Bunlar farklı kategorilere ayrılır; en yaygın kullanılanları mesafe sınırlamaları ve açı sınırlamalarıdır.
Mesafe kısıtlamaları
NOESY deneyindeki bir çapraz tepe , söz konusu iki çekirdek arasındaki uzamsal yakınlığı belirtir. Böylece her bir tepe, çekirdekler arasında, genellikle 1.8 ile 6 angstrom arasında bir maksimum mesafeye dönüştürülebilir . Bir NOESY zirvesinin yoğunluğu, eksi 6. güce olan mesafeyle orantılıdır, bu nedenle mesafe, tepenin yoğunluğuna göre belirlenir. Yoğunluk-mesafe ilişkisi kesin değildir, bu nedenle genellikle bir mesafe aralığı kullanılır.
NOESY piklerinin kimyasal kaymalara bağlı olarak doğru çekirdeklere atanması büyük önem taşımaktadır. Bu görev manuel olarak gerçekleştirilirse, proteinler genellikle binlerce NOESY zirvesine sahip olduğundan, genellikle çok emek yoğundur. Integrative NMR platformundaki PASD/ XPLOR-NIH , UNIO , CYANA , ARIA / CNS ve AUDANA/ PONDEROSA -C/S gibi bazı bilgisayar programları bu görevi, birleştirilmiş pik konumlarının ve pik hacimlerinin manuel olarak önceden işlenmiş listelerinde otomatik olarak gerçekleştirir. bir yapı hesaplamasına Yinelemeli olarak rafine edilmiş tepe listelerinin hantal ihtiyacı olmadan ham NOESY verilerine doğrudan erişim, şimdiye kadar yalnızca XPLOR-NIH'de uygulanan PASD algoritması , UNIO yazılım paketinde uygulanan ATNOS/CANDID yaklaşımı ve PONDEROSA-C/S tarafından sağlandı. ve böylece gerçekten de objektif ve verimli NOESY spektral analizini garanti eder.
Mümkün olduğunca doğru atamalar elde etmek için, proton boyutundaki örtüşmeyi çözmeye yardımcı olduklarından, karbon-13 ve nitrojen-15 NOESY deneylerine erişim büyük bir avantajdır. Bu, daha hızlı ve daha güvenilir atamalara ve dolayısıyla daha iyi yapılara yol açar.
Açı sınırlamaları
Mesafe sınırlamalarına ek olarak, kimyasal bağların burulma açılarında, tipik olarak psi ve phi açılarında sınırlamalar oluşturulabilir. Bir yaklaşım , bağlantı sabitlerinden açı sınırlamaları oluşturmak için Karplus denklemini kullanmaktır . Başka bir yaklaşım, açı sınırlamaları oluşturmak için kimyasal kaymaları kullanır. Her iki yöntem de alfa karbon etrafındaki geometrinin bağlantı sabitlerini ve kimyasal kaymaları etkilediği gerçeğini kullanır, bu nedenle bağlantı sabitleri veya kimyasal kaymalar verildiğinde, burulma açıları hakkında nitelikli bir tahmin yapılabilir.
Oryantasyon kısıtlamaları

Bir numunedeki analit molekülleri, numune koşulları manipüle edilerek spektrometrenin harici manyetik alanına göre kısmen sıralanabilir. Yaygın teknikler , numuneye bakteriyofajların veya bisellerin eklenmesini veya numunenin gerilmiş bir poliakrilamid jel içinde hazırlanmasını içerir . Bu, küresel olmayan moleküllerin belirli yönelimlerini destekleyen yerel bir ortam yaratır. Normalde çözelti NMR'sinde, molekülün hızlı yuvarlanması nedeniyle çekirdekler arasındaki dipolar eşleşmelerin ortalaması alınır. Bir oryantasyonun hafif aşırı popülasyonu, artık bir dipolar eşleşmenin gözlemlenmesi gerektiği anlamına gelir . Dipolar kuplaj, katı hal NMR'de yaygın olarak kullanılır ve tek bir global referans çerçevesine göre bağ vektörlerinin göreli yönelimi hakkında bilgi sağlar. Tipik olarak NH vektörünün oryantasyonu, HSQC benzeri bir deneyde incelenir. Başlangıçta, önceden belirlenmiş yapıların iyileştirilmesi için artık dipolar kuplajlar kullanıldı, ancak de novo yapı belirleme girişimleri de yapıldı.
Hidrojen-döteryum değişimi
NMR spektroskopisi çekirdeğe özgüdür. Böylece hidrojen ve döteryum arasında ayrım yapabilir. Proteindeki amid protonları çözücü ile kolayca değiş tokuş yapar ve çözücünün farklı bir izotop, tipik olarak döteryum içermesi durumunda , reaksiyon NMR spektroskopisi ile izlenebilir. Belirli bir amid değişiminin ne kadar hızlı olduğu solvent erişilebilirliğini yansıtır. Böylece amid değişim oranları, proteinin hangi kısımlarının gömülü olduğu, hidrojen bağlı olduğu, vb. hakkında bilgi verebilir. Yaygın bir uygulama, bir kompleks ile serbest bir formun değişimini karşılaştırmaktır. Komplekste korunan amidlerin etkileşim ara yüzeyinde olduğu varsayılır.
Yapı hesaplama
Deneysel olarak belirlenen kısıtlamalar, yapı hesaplama işlemi için girdi olarak kullanılabilir. XPLOR-NIH , CYANA veya GeNMR gibi bilgisayar programlarını kullanan araştırmacılar, proteinlerin bağ uzunlukları ve açıları gibi genel özelliklerine ek olarak, mümkün olduğu kadar çok kısıtlamayı karşılamaya çalışırlar. Algoritmalar, kısıtlamaları ve genel protein özelliklerini enerji terimlerine dönüştürür ve ardından bu enerjiyi en aza indirmeye çalışır. Süreç, veriler belirli bir kıvrımı dikte etmek için yeterliyse yakınsayacak bir yapılar topluluğu ile sonuçlanır.
Yapı doğrulama
Elde edilen yapılar topluluğunun bir "deneysel model", yani belirli türden deneysel verilerin bir temsili olduğuna dikkat etmek önemlidir. Bu gerçeği kabul etmek gerçekten önemlidir çünkü bu, modelin bu deneysel verilerin iyi veya kötü bir temsili olabileceği anlamına gelir. Genel olarak, bir modelin kalitesi, onu oluşturmak için kullanılan deneysel verilerin hem niceliğine hem de kalitesine ve bu tür verilerin doğru yorumlanmasına bağlı olacaktır.
Her deneyin ilişkili hataları olduğunu hatırlamak önemlidir. Rastgele hatalar , ortaya çıkan yapıların tekrarlanabilirliğini ve kesinliğini etkileyecektir . Hatalar sistematik ise, modelin doğruluğu etkilenecektir. Kesinlik, ölçümün tekrarlanabilirlik derecesini gösterir ve genellikle aynı koşullar altında ölçülen veri setinin varyansı olarak ifade edilir . Ancak doğruluk, bir ölçümün "gerçek" değerine yaklaşma derecesini gösterir.
İdeal olarak, bir protein modeli, temsil eden gerçek molekül ne kadar uygunsa o kadar doğru olacaktır ve atomlarının konumları hakkında daha az belirsizlik olduğundan daha kesin olacaktır. Pratikte, protein modellerini karşılaştıracak bir "standart molekül" yoktur, bu nedenle bir modelin doğruluğu, model ile bir dizi deneysel veri arasındaki uyum derecesi ile verilir. Tarihsel olarak, NMR tarafından belirlenen yapılar, genel olarak, X-ışını kırınımı ile belirlenenlerden daha düşük kalitede olmuştur. Bu, kısmen, NMR tarafından elde edilen verilerde yer alan daha düşük miktarda bilgiden kaynaklanmaktadır. Bu gerçek nedeniyle, aynı protein için X-ışını kırınımı ile belirlenen benzersiz konformasyonla karşılaştırarak NMR topluluklarının kalitesini belirlemek yaygın bir uygulama haline gelmiştir. Bununla birlikte, X-ışını kırınım yapısı mevcut olmayabilir ve çözeltideki proteinler esnek moleküller olduğundan, tek bir yapı ile temsil edilen bir protein, bir proteinin atomik pozisyonlarının içsel varyasyonunun hafife alınmasına yol açabilir. NMR veya X-ışını kristalografisi ile belirlenen bir dizi konformasyon, bir proteinin deneysel verilerinin benzersiz bir konformasyondan daha iyi bir temsili olabilir.
Bir modelin faydası, en azından kısmen, modelin doğruluk ve kesinlik derecesiyle verilecektir. Nispeten zayıf kesinliğe sahip doğru bir model, bir dizi proteinin yapıları arasındaki evrimsel ilişkileri incelemek için faydalı olabilirken, rasyonel ilaç tasarımı hem kesin hem de doğru modeller gerektirir. Elde edildiği kesinlik derecesine bakılmaksızın doğru olmayan bir model çok kullanışlı olmayacaktır.
Protein yapıları hata içerebilen deneysel modeller olduğu için bu hataların tespit edilebilmesi çok önemlidir. Hataların tespit edilmesini amaçlayan süreç doğrulama olarak bilinir. Doğrulamak yapıları için çeşitli yöntemler bazı gibi istatistiksel olarak, var PROCHECK ve NE IF diğerleri gibi fiziksel ilkelere dayanmaktadır ise CheShift , ya da istatistiki ve fiziği ilkeleri bir karışımı PSVs .
dinamikler
Yapılara ek olarak, nükleer manyetik rezonans , proteinin çeşitli bölümlerinin dinamikleri hakkında bilgi verebilir . Bu genellikle sipariş parametrelerini, korelasyon sürelerini ve kimyasal değişim oranlarını belirlemek için T 1 ve T 2 gibi gevşeme sürelerinin ölçülmesini içerir . NMR gevşemesi, bir molekül içindeki yerel dalgalanan manyetik alanların bir sonucudur . Lokal dalgalı manyetik alanlar moleküler hareketler tarafından üretilir. Bu şekilde, gevşeme zamanlarının ölçümleri, atom seviyesinde bir molekül içindeki hareketler hakkında bilgi sağlayabilir. Protein dinamiğine ilişkin NMR çalışmalarında, nitrojen-15 izotopu, gevşeme sürelerinin moleküler hareketlerle ilişkilendirilmesi nispeten basit olduğu için çalışmak için tercih edilen çekirdektir. Ancak bu, proteinin izotop etiketlemesini gerektirir. T 1 ve T, 2 gevşeme süreleri çeşitli kullanılarak ölçülebilir HSQC deneyler tabanlı. Tespit edilebilen hareket türleri, yaklaşık 10 pikosaniye ile yaklaşık 10 nanosaniye arasında değişen bir zaman ölçeğinde meydana gelen hareketlerdir. Ayrıca, yaklaşık 10 mikrosaniye ile 100 milisaniye arasında değişen bir zaman ölçeğinde gerçekleşen daha yavaş hareketler de incelenebilir. Bununla birlikte, nitrojen atomları esas olarak bir proteinin omurgasında bulunduğundan, sonuçlar esas olarak bir protein molekülünün en sert kısmı olan omurganın hareketlerini yansıtır. Bu nedenle, nitrojen-15 gevşeme ölçümlerinden elde edilen sonuçlar tüm proteini temsil etmeyebilir. Bu nedenle, son zamanlarda karbon-13 ve döteryumun gevşeme ölçümlerini kullanan teknikler geliştirilmiştir, bu da proteinlerdeki amino asit yan zincirlerinin hareketlerinin sistematik olarak incelenmesini sağlar. Peptitlerin ve tam uzunluktaki proteinlerin dinamikleri ve esnekliği ile ilgili zorlu ve özel bir çalışma durumu, düzensiz yapılarla temsil edilir. Günümüzde proteinlerin düzensizlik veya yapı eksikliği olarak bilinen daha esnek bir davranış sergileyebildiği kabul edilen bir kavramdır; bununla birlikte, proteinin tamamen işlevsel bir durumunu temsil eden statik bir resim yerine bir yapılar topluluğu tanımlamak mümkündür. Bu alanda özellikle yeni nabız dizileri, teknolojik gelişme ve bu alandaki araştırmacıların titiz eğitimi açısından birçok ilerleme temsil edilmektedir.
Büyük proteinler üzerinde NMR spektroskopisi
Geleneksel olarak, nükleer manyetik rezonans spektroskopisi, nispeten küçük proteinler veya protein alanları ile sınırlandırılmıştır. Bu, kısmen daha büyük proteinlerde örtüşen tepe noktalarının çözülmesi problemlerinden kaynaklanmaktadır, ancak bu, izotop etiketleme ve çok boyutlu deneylerin tanıtılmasıyla hafifletilmiştir. Daha ciddi bir sorun da büyük proteinlerde manyetizasyonun daha hızlı gevşemesidir, bu da sinyali algılamak için daha az zaman olduğu anlamına gelir. Bu da zirvelerin daha geniş ve zayıf olmasına ve sonunda kaybolmasına neden olur. İki teknik gevşeme azaltmak için tanıtılmıştır: enine gevşeme optimize spektroskopisi (Trosy) ve dötertumlanma proteinleri. Bu teknikleri kullanarak proteinleri 900 kDa şaperon GroES - GroEL ile kompleks halinde incelemek mümkün olmuştur .
Sürecin otomasyonu
NMR ile yapı belirleme, geleneksel olarak, yüksek eğitimli bir bilim adamı tarafından verilerin etkileşimli analizini gerektiren zaman alıcı bir süreç olmuştur. Yapı belirleme verimini artırmak ve protein NMR'sini uzman olmayanlar için erişilebilir kılmak için işlemi otomatikleştirmeye büyük ilgi olmuştur (bkz. yapısal genomik ). En çok zaman alan iki süreç, diziye özgü rezonans ataması (omurga ve yan zincir ataması) ve NOE atama görevleridir. Otomatik bir biçimde genel NMR yapısı belirleme sürecinin tek tek bölümlerini hedefleyen birkaç farklı bilgisayar programı yayınlanmıştır. Çoğu ilerleme, otomatik NOE ataması görevi için elde edilmiştir. Şimdiye kadar, tüm protein NMR yapısı belirleme sürecini herhangi bir insan müdahalesi olmadan otomatik bir şekilde gerçekleştirmek için yalnızca FLYA ve UNIO yaklaşımı önerildi. Son zamanlarda, NMRFAM-SPARKY'deki APES (iki harfli kod: ae), I-PINE/PINE-SPARKY (iki harfli kod: ep; I-PINE web sunucusu ) ve PONDEROSA (iki harfli- code: c3, up; PONDEROSA web server ) entegre edilmiştir, böylece her adımda görsel doğrulama özelliği ile tam otomasyon sunar. Daha hızlı ve otomasyona daha uygun hale getirmek için yapı hesaplama protokolünü standart hale getirmek için de çaba sarf edilmiştir.
Ayrıca bakınız
- NMR spektroskopisi
- Nükleer manyetik rezonans
- Karbonhidratların nükleer manyetik rezonans spektroskopisi
- Nükleik asitlerin nükleer manyetik rezonans spektroskopisi
- Protein kristalizasyonu
- Protein dinamiği
- Gevşeme (NMR)
- X-ışını kristalografisi
Referanslar
daha fazla okuma
- T. Kevin Hitchens; Gordon S. Kuralı (2005). Protein NMR Spektroskopisinin Temelleri (Yapısal Biyolojiye Odaklanma) . Berlin: Springer. ISBN'si 978-1-4020-3499-2.
- Quincy Teng (2005). Yapısal biyoloji: pratik NMR uygulamaları . Berlin: Springer. Bibcode : 2005stbi.book.....T . ISBN'si 978-0-387-24367-2.
- Mark Rance; Kavanagh, John; Wayne J. Fairbrother; Arthur W. Hunt III; Skelton, NNicholas J. (2007). Protein NMR spektroskopisi: ilkeler ve uygulama (2. baskı). Boston: Akademik Basın. ISBN'si 978-0-12-164491-8.
- Kurt Wüthrich (1986). Proteinlerin ve nükleik asitlerin NMR'si . New York: Wiley. ISBN'si 978-0-471-82893-8.
Dış bağlantılar
|
Proteinlerin Nükleer manyetik rezonans spektroskopisi hakkında kütüphane kaynakları |
- Döterasyonsuz Büyük Proteinlerin Omurga ve Yan Zincir Rezonanslarının Atamaları için NOESY Tabanlı Strateji (bir protokol)
- Relax Yazılımı NMR dinamiklerinin analizi için
- ProSA-web Deneysel veya teorik olarak belirlenmiş protein yapılarındaki hataların tanınması için Wayback Machine Web hizmetinde 2011-05-11 arşivlendi
- Seyrek deneysel verilerden protein yapısının belirlenmesi - bir giriş sunumu
- Protein NMR Protein NMR deneyleri