kokolitovirüs -Coccolithovirus
| kokolitovirüs | |
|---|---|

|
|
| Giant coccolithovirus, Emiliania huxleyi virus 86 (oklu), bir Emiliania huxleyi coccolithophore'u enfekte ediyor | |
|
Virüs sınıflandırması |
|
| (rütbesiz): | Virüs |
| Bölge : | Varidnaviria |
| Krallık: | Bamfordvirae |
| filum: | nükleositovirikota |
| Sınıf: | Megaviricetes |
| Emir: | Algaviraller |
| Aile: | Phycodnaviridae |
| cins: | kokolitovirüs |
| Suşlar | |
|
|
Coccolithovirus , Phycodnaviridae ailesindekidev çift sarmallı DNA virüsünün bir cinsidir. Özellikle Alg, Emiliania huxleyi , bir tür coccolithophore , doğal taşıyıcılardan olarak görev yapar. Bu cinste tanımlanmış tek bir tür vardır: Emiliania huxleyi virus 86 .
Yapı
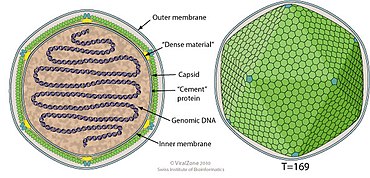
Kokolitovirüsler zarflıdır, ikosahedraldir ve 100-220 nm arasında değişen bir çapa sahiptir. Bunların genomları uzunluğu 410-415kb arasında, doğrusal ve tahmin kodlama yaklaşık 472 proteinler için.
| cins | Yapı | Simetri | kapsid | genomik düzenleme | genomik segmentasyon |
|---|---|---|---|---|---|
| kokolitovirüs | iki yüzlü | T=169 | Zarflı | Doğrusal | monopartit |
Yaşam döngüsü
Coccolithoviruses, nükleositoplazmik büyük dsDNA virüsleri ( NCLDV'ler ) olarak bilinen geniş ve filogenetik olarak çeşitli bir virüs grubuna ait beş aileden biri olan Phycodnaviridae ailesinin bir parçasıdır . Bu virüsler ya yalnızca konak hücrenin sitoplazmasında çoğalır ya da yaşam döngüsüne konakçı çekirdeğinde başlar, ancak bunu sitoplazmada tamamlar. EhV-86 durumunda enfeksiyon stratejisi tam olarak anlaşılmamıştır, ancak Mackinder ve ark. (2009) aşağıdaki modeli önermiştir: Virüs, endositoz yoluyla konak hücreye girer , ardından lipid zarının konak vakuol zarı ile füzyonu ve nükleoprotein çekirdeğinin sitoplazmaya salınması izler . Alternatif olarak virüs zarı, doğrudan konak plazma zarı ile kaynaşabilir. Virüs genomu daha sonra kapsitten çekirdeğe salınır ve burada viral DNA polimeraz tarafından kopyalanır . Çoğaltılan genom sitoplazmada toplanmış kapsidlere paketlenir ve yeni oluşan (400-1000'e kadar) virionların plazma zarına taşındığı ve kontrollü bir tomurcuklanma mekanizması tarafından salındığı düşünülür, bu da konakçı hücrenin hücresel yıkımına yol açar. .
Yaşam döngüsünün G2 ve M aşaması sırasında kokosfer eksiktir ve plazma zarının virüse maruziyeti artar. Sağlam bir kokosfer enfeksiyonu ile bile, kokolitler arasında doğal olarak oluşan boşluklar nedeniyle oluşabilir.
E. huxleyi 250,000 km ulaşabilir mevsimsel alg çoğalmaları oluşturulması için bilinen 2 , 10, üst 200 m artar hangi hücre yoğunluğu sırasında 3 10 bulundunuz 5 ml deniz suyu başına hücre. Bu alg patlamaları genellikle 5-8 gün sonra çöker ve birkaç çalışma çiçeklenme sonlandırmasının özünde kokolitovirüs enfeksiyonu ile bağlantılı olduğunu göstermiştir. Algal konaklar arasında virüslerin geçişi, pasif difüzyon yoluyla gerçekleşir. Ayrıca, kopepodlarda EhV DNA'sı da tespit edildi, bu da virüslerin virüs taşıyan zooplanktonlar tarafından daha da dağıldığı önerisine yol açtı .
Genetik şifre
Bugüne kadar 14 EhV suşu 1999 ve 2008 yılları arasında öncelikle İngiliz Kanalından (EC) ve aynı zamanda Norveç ve İskoçya Sahillerinden izole edilmiştir . Tüm bu 14 suşun kısmi sekansları mevcut olmasına rağmen, genomun yüksek oranda tekrarlayan doğası nedeniyle tamamen sekanslanmış tek suş EhV-86'dır. EhV-86'nın sekanslanması, 472 öngörülen kodlama sekansı ( CDS ) ile 407.339 bp uzunluğunda dairesel bir genom ortaya çıkardı . Bu varsayılan genlerin dikkate değer bir şekilde %80'inin bugüne kadar veritabanı homologları yoktur. Dizi benzerliği veya protein alanı eşleşmeleri nedeniyle bir fonksiyon atanabilenler arasında DNA ve RNA polimeraz alt birimleri, sekiz proteaz ve ayrıca sfingolipid biyosentezinde yer alan proteinleri kodlayan en az dört gen bulunur. Bunların konakçıdan yatay gen transferi yoluyla elde edildiği gösterilmiştir .
Ayrıca, EhV-86 genomu, genom içinde tekrarlayan bölgelerin üç farklı ailesini (A, B, C) ortaya çıkardı. C Ailesi, kodlamayan ve muhtemelen replikasyonun ( ORF ) kaynağının bir parçası olan AT açısından zengin tekrarlardan oluşur . B Ailesi, tahmin edilen sekiz CDS'nin protein ürünlerinde bulunan GC açısından zengin tekrarlardır. Aile A homolog bölgelerinin boyutu 30-300 bp arasında değişir ve genomun 104 kbp (200-304 kbp) bölümünde bulunur ve mevcut veri tabanlarında bilinen fonksiyona sahip gen homologlarını içermez. A Ailesi tekrar birimleri kodlamasızdır ve bu bölge içinde toplamda 106 yerde görünen bir nanomer (GTTCCC(T/C)AA) ile karakterize edilir. Bu dizi, 86 CDS'nin doğrudan yukarı akışında bulunur ve ilişkili CDS'lerin ekspresyonunun kontrol edilmesinde rol oynaması muhtemeldir.
Enfeksiyon sırasında, CDS ekspresyonuna göre üç faza bölünebilen viral genlerin belirgin bir ekspresyon paterni tarif edildi. Enfeksiyondan bir saat sonra, 39 viral gen kopyalandı, ardından 2 saat sonra 194 gen ve 4 saat sonra 71 gen daha kaydedildi. Enfeksiyondan 1 saat sonra ifade edilen 39 genin tümü 104 kbp bölgesinde yer alır ve nanomeri doğrudan başlangıç kodonunun yukarısında bulunur. Viral RNA polimeraz ekspresyonu enfeksiyondan 1 saat sonra tespit edilmediğinden, promotörün paketlenmiş bir viral RNA polimeraz tarafından mı yoksa konakçı RNA polimeraz tarafından mı tanındığı henüz belirlenmemiştir. Bununla birlikte, EhV-86 virionunun proteomik analizi, herhangi bir ana RNA polimeraz alt birimini saptamada başarısız oldu.
Tarih
Wilson ve Marine Biological Association (MBA), University of East Anglia ve Plymouth Marine Laboratory'deki (PML) ekibi virüsü ilk olarak 1999'da gözlemledi. Daha sonra 2005 yazında Plymouth Deniz Laboratuvarı'ndaki araştırmacılar (Willie Wilson ve ark. ) ve Sanger Enstitüsü'nde (Holden ve diğerleri), EhV-86 suşu için genomu sıraladı ve onu bir " dev virüs " ve genom tarafından bilinen en büyük deniz virüsü yapan 472 protein kodlayan gene sahip olduğunu buldu .
Coccolithoviruses genomunun ilk araştırmasından sonra, seramid üretiminden sorumlu bir dizi gen keşfedildi. Seramid hücre ölümünde kontrol edici bir faktördür ve şu anda Coccolithovirus'ün bunu Emiliania huxleyi'nin ömrünü uzatmak için kullandığı ve konak hücreyi kopyalamak için kullandığı düşünülmektedir . Bu, bugüne kadar başka herhangi bir viral genomda görülmeyen eşsiz bir yetenektir.
Ayrıca bakınız
- Mimivirus - genom tarafından kaydedilen en büyük dev virüs
- Mycoplasma genitalium , Pelagibacter ubique - bilinen en küçük bakterilerden bazıları
- Nanoarchaeum - bilinen en küçük arkeum
- En küçük organizmalar
- Parvovirus - bilinen en küçük virüs ailesi
- Phycodnaviridae - virüsleri enfekte eden algler
Notlar
Referanslar
daha fazla okuma
- Wilson, WH, Schroeder, DC, Allen, MJ, Holden, MTG, Parkhill, J., Barrell, BG, Churcher, C., Hamlin, N., Mungall, K., Norbertczak, H., Quail, MA, Price , C., Rabbinowitsch, E., Walker, D., Craigon, M., Roy, D. ve Ghazal, P. (2005) Komple Genom Dizisi ve Bir Coccolithovirus'ün Litik Faz Transkripsiyon Profili . Bilim 5737 , 1090-1092
- Allen, MJ, Schroeder, DC, Holden, MT ve Wilson, WH (2006) Coccolithoviridae'nin Evrimsel Tarihi . Mol Biol Evol. 23 , 86–92 ( Atina'da oturum açılması gerekir)