Kromil florür - Chromyl fluoride
|
|
| İsimler | |
|---|---|
|
IUPAC adı
Difloro (diokso) krom
|
|
| Diğer isimler
Kromil Florür, Krom Diflorür Dioksit
|
|
| Tanımlayıcılar | |
|
3B modeli ( JSmol )
|
|
| ChemSpider | |
| EC Numarası | |
|
PubChem Müşteri Kimliği
|
|
| UNII | |
|
|
|
|
| Özellikleri | |
| Cr F 2 O 2 | |
| Molar kütle | 121,991 g · mol −1 |
| Görünüm | mor kristaller |
| Erime noktası | 31,6 ° C (88,9 ° F; 304,8 K) |
| Kaynama noktası | 30 ° C (86 ° F; 303 K) Yüceltmeler |
| Yapısı | |
| monoklinik | |
| P2 1 / c, No. 14 | |
| C 2v | |
|
Formül birimleri ( Z )
|
4 |
| Tehlikeler | |
| Ana tehlikeler | Oksidan |
| Bağıntılı bileşikler | |
|
Bağıntılı bileşikler
|
kromil klorür |
|
Aksi belirtilmedikçe, veriler standart hallerinde (25 ° C [77 ° F], 100 kPa) malzemeler için verilmiştir. |
|
|
|
|
| Bilgi kutusu referansları | |
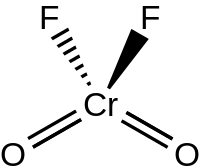
Kromil florür bir bir inorganik bileşik , formül CrO ile 2 F 2 . Turuncu-kırmızı bir sıvıya eriyen mor-kırmızı renkli kristal bir katıdır.
Yapısı
Sıvı ve gaz CrO 2 K 2 mı tetrahedral geometri C ile 2v simetri çok gibi, kromil klorür . Kromil florür , katı halde florür köprüleri (O 2 Cr (μ-F) 4 CrO 2 olarak ) üzerinden dimerize olur ve P2 1 / c uzay grubunda Z = 4 ile kristalleşir. Cr = O bağ uzunlukları yaklaşık 157 pm'dir , Cr – F bağ uzunlukları ise 181.7, 186.7 ve 209.4 pm'dir. Krom, altı koordinasyon numarasıyla çarpık oktahedral bir konumda bulunur.
Tarih ve hazırlık
Saf kromil florür ilk olarak 1952'de Alfred Engelbrecht ve Aristid von Grosse tarafından bildirildiği gibi izole edildi . İlk olarak 19. yüzyılın başlarında fluorspar (CaF 2 ), kromatlar ve sülfürik asit karışımı ısıtıldığında kırmızı buhar olarak gözlendi . Bunlar kırmızı buharlar başlangıçta CrF olduğu düşünülen 6 bazı kimyacılar bir CrO kabul rağmen, 2 F 2 CrO için yapı benzer 2 Cl 2 . Kromil florürün ilk orta derecede başarılı sentezi, hidrojen florürün alkali kromatlarla reaksiyonunu inceleyen Fredenhagen tarafından bildirildi . Daha sonraki bir girişim, von Wartenberg'in kromil klorürü elementel flor ile işleyerek saf olmayan CrO 2 F 2 hazırladığını gördü . Diğer bir girişim, saf olmayan sıvı CrO, sonuçta dikromat ile HF tedavi Wiechert tarafından yapıldı 2 F 2 -40 ° C de.
Engelbrecht ve CrO von GROßE en sentezi 2 F 2 ve en çok ardışık sentezler, muamele edilmesini kapsamaktadır krom trioksit bir florlayıcı madde ile:
- CrO 3 + 2 HF → CrO 2 F 2 + H 2 O
Su hali hazırda CrO hidrolize edecek Reaksiyon, geri dönüşümlü 2 F 2 CRO'ya geri 3 .
Tarafından yayınlanan yaklaşım Georg Brauer içinde Hazırlayıcı Anorganik Kimya El Kitabı direkt florlanması von Wartenberg yaklaşımı üzerine çekti:
- CrO 2 Cl 2 + F 2 → CrO 2 F 2 + Cl 2
Diğer yöntemler arasında klor florür , karbonil florür veya bazı metal heksaflorürler ile muamele bulunur :
- CrO 3 + 2 ClF → CrO 2 F 2 + Cl 2 + O 2
- CrO 3 + COF 2 → CrO 2 F 2 + CO 2
- CrO 3 + MF 6 → CrO 2 F 2 + MOF 4 (M = Mo, W)
Green ve Gard tarafından, tungsten ve molibden florürlerini içeren son yöntemin, büyük miktarlarda saf CrO 2 F 2'ye giden çok basit ve etkili yollar olduğu bildirildi . Reaksiyonlar 120 ° C'de yapıldığında% 100 verim bildirdiler. MoF 6 ve WF 6'nın nispi reaktivitelerinden beklendiği gibi molibden reaksiyonu, tungstenden daha kolay ilerledi.
Tepkiler
Kromil florür, hidrokarbonları ketonlara ve karboksilik asitlere dönüştürebilen güçlü bir oksitleyici ajandır . Diğer kromil bileşiklerinin hazırlanmasında da bir reaktif olarak kullanılabilir. Diğer bazı florür bileşikleri gibi, CrO 2 F 2 de cam ve kuvars ile reaksiyona girer, bu nedenle bileşiği işlemek için silikonsuz plastikler veya metal kaplar gerekir. İnorganik sistemlerdeki oksitleyici gücü de araştırılmıştır. Kromil florür, flor atomlarını metal oksitlerle değiştirebilir.
- CrO 2 F 2 + MO → MF 2 + CrO 3
Kromil florür ayrıca bor ve silikon oksitlerini florürlere dönüştürecektir.
Kromil florür , turuncu renkli florokromatlar üretmek için perfloroheptan (çözücü) içinde alkali ve alkali toprak metal florürlerle reaksiyona girer :
- CrO 2 F 2 + 2 MF → M 2 CrO 2 F 4
Kromil florür ayrıca Lewis asitleri ile reaksiyona girer , organik asit anhidritlerden karboksilat ligandları çeker ve bir asil florür yan ürünü üretir :
- CrO 2 F 2 + 2 (CF 3 CO) 2 O → CrO 2 (CF 3 COO) 2 + 2 CF 3 COF
Kromil florür, zayıf bazlar NO, NO 2 ve SO 2 ile eklentiler oluşturur .
Referanslar
-
^ a b
Brauer, Georg (1963) [1960]. "Kromil Florür - CrO
2 F
2 " . Handbook of Preparative Inorganic Chemistry, Cilt 1 (2. baskı). Stuttgart; New York: Ferdinand Enke Verlag ; Academic Press, Inc. s. 258–259. ISBN 978-0-32316127-5 . - ^ a b c Gard, GL (1986) "Chromium Difluoride Dixide (Chromyl Fluoride)," Inorg. Synth. , 24 , 67-69, doi : 10.1002 / 9780470132555.ch20 .
- ^ Hobbs, WE (1958) "Kromil Florür ve Kromil Klorürün Kızılötesi Soğurma Spektrumları" J. Chem. Phys. 28 ( 6 ), 1220-1222, doi : 10.1063 / 1.1744372 .
- ^ Supeł, J .; Abram, U .; Hagenbach, A .; Seppelt, K. (2007) "Teknesyum Florür Trioksit, TcO 3 F, Hazırlama ve Özellikler." Inorg. Chem. , 46 ( 14 ), 5591–5595, doi : 10.1021 / ic070333y .
- ^ a b c Engelbrecht, A .; von Grosse, A. (1952) "Pure Chromyl Fluoride" J. Am. Chem. Soc. 74 ( 21 ), 5262–5264, doi : 10.1021 / ja01141a007 .
-
^ a b von Wartenberg, H. (1941) "Über höhere Chromfluoride ( CrF
4 , CrF
5 ve CrO
2 F
2 ) "[Daha yüksek krom florürler ( CrF
4 , CrF
5 ve CrO
2 F
2 )], Z. Anorg. Allg. Chem. [Almanca], 247 ( 1-2 ), 135–146, doi : 10.1002 / zaac.19412470112 . - ^ Yeşil, PJ; Gard GL (1977) "kromil Florür. 5. Yeni Hazırlayıcı yollarının Kimya CrO için 2 F 2 ," Inor. Chem. 16 ( 5 ), 1243–1245, doi : 10.1021 / ic50171a055 .
- ^ a b c d Brown, SD; Yeşil, PJ; Gard, GL (1975) "Kromil Florür III Kimyası: İnorganik Sistemlerle Reaksiyonlar" J. Fluorine Chem. 5 ( 3 ), 203-219, doi : 10.1016 / S0022-1139 (00) 82482-3 .
