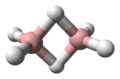boranlar - Boranes

Boranlar , formülü B x H y olan bileşiklere ve ilgili anyonlara verilen isimdir . Bu tür birçok boran bilinmektedir. En yaygın olanı 1 ila 12 bor atomuna sahip olanlardır. Birkaç pratik uygulamaya sahip olmalarına rağmen, boranlar hidrokarbonlarda görülen modellerden çok farklı yapılar ve bağlar sergilerler. Boranlar ve hidrokarbonların melezleri, karboranlar da iyi gelişmiştir.
Tarih
Boran kimyasının gelişmesi, yapı ve bağların yanı sıra sentetik yöntemlerde de yeniliklere yol açmıştır. İlk olarak, hem piroforik hem de uçucu olan diboran ve türevlerinin çoğunu işlemek için yeni sentetik teknikler gerekliydi . Alfred Stock , bu amaç için cam vakum hattını icat etti.
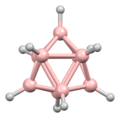
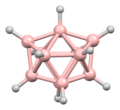
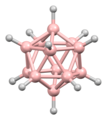
Diboran'ın yapısı, keşfinden yıllar sonra 1943'te doğru bir şekilde tahmin edildi. Bor hidrit kümelerinin yapıları 1948'den başlayarak dekaboranın karakterizasyonu ile belirlendi . William Lipscomb , bu ve sonraki birçok kristalografik araştırma için 1976'da Kimyada Nobel ödülüne layık görüldü . Bu araştırmalar deltahedral yapıların, yani BH merkezlerinin üçgen dizilerinden oluşan ağların yaygınlığını ortaya çıkardı.
Kümelerin bağlanması , boranların yapılarını tahmin etmek için kullanılabilecek Çokyüzlü iskelet elektron çifti teorisi ve Wade'in kurallarını başlattı . Bu kuralların birçok küme bileşiğinin yapısını tanımladığı bulundu.
Uranyum borhidrürün uranyum izotoplarını zenginleştirme potansiyeli ve hava balonlarını şişirmek için bir hidrojen kaynağı olması nedeniyle, II. Dünya Savaşı sırasında boranlara ilgi arttı . ABD'de, Schlesinger liderliğindeki bir ekip , anyonik bor hidritlerin ve ilgili alüminyum hidritlerin temel kimyasını geliştirdi. Schlesinger'in iş bor hidrür bir dizi temelini atmıştır reaktif için organik sentez onun öğrenci tarafından geliştirildi çoğu, Herbert C. Brown . Boran bazlı reaktifler artık organik sentezde yaygın olarak kullanılmaktadır. Brown, bu çalışması için 1979'da Nobel Kimya Ödülü'ne layık görüldü .
Kimyasal formül ve adlandırma kuralları
Boran kümeleri aşağıdaki gibi sınıflandırılır, burada n , tek bir kümedeki bor atomlarının sayısıdır:
| küme türü | Kimyasal formül | Örnek | Notlar |
|---|---|---|---|
| hiperkloz - | B , n , H , n | Dengesiz; türevler bilinmektedir | |
| yakın - | B n H n 2− | sezyum dodecaborat | |
| nido - | B n H n+4 | pentaboran(9) | |
| arakno - | B n H n+6 | pentaboran(11) | |
| hifo - | B n H n+8 | Sadece eklentilerde bulunur |
Saf ve Uygulamalı Kimya kuralları Uluslararası Birliği için sistematik adlandırma bor atomlarının sayısı ve son olarak parantez içinde hidrojen atomlarının sayısı, ardından bir bileşik sınıfını, belirten bir önek dayanır. Anlam konusunda herhangi bir belirsizlik yoksa, örneğin yalnızca bir yapısal tip mümkünse, çeşitli ayrıntılar atlanabilir. Bazı yapı örnekleri aşağıda gösterilmiştir.
boran
BH 3Diboran(6)
B 2 H 6arakno -Tetraborane(10)
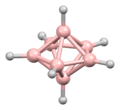
B 4 H 10Pentaboran(9)
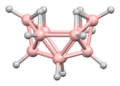
B 5 H 9Dekaboran(14)
B 10 H 14
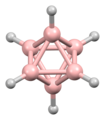
Dodecaborate(12)
B 12 H 12 2−
Anyonların adlandırılması şu şekilde gösterilmiştir:
- oktahidridopentaborat, B 5 H 8 −
Önce hidrojen sayımı, ardından bor sayımı belirtilir. -ate soneki anyonlarla birlikte uygulanır . İyonik yük değeri, kimyasal formüle dahil edilmiştir, ancak sistematik adın bir parçası değildir.
Boranlarda bağlanma
Boranlar klasik olmayan bağlı bileşiklerdir, yani moleküldeki tüm bitişik atom çiftleri arasında 2 merkezli, 2 elektronlu bağlar oluşturmak için yeterli elektron yoktur. Daha büyük boranlardaki bağlanmanın bir açıklaması William Lipscomb tarafından formüle edilmiştir . Şunları içeriyordu:
- 3 merkezli 2 elektronlu BHB hidrojen köprüleri
- 3 merkezli 2 elektronlu BBB bağları
- 2 merkezli 2 elektronlu bağlar (BB, BH ve BH 2'de )
Lipscomb'un metodolojisinin yerini büyük ölçüde bir moleküler orbital yaklaşım almıştır. Bu, çok merkezli bağ kavramının genişletilmesine izin verir. Örneğin, ikosahedral iyonda [B 12 H 12 ] 2- , tamamen simetrik (A g simetrisi) moleküler orbital, 12 bor atomunun tümü arasında eşit olarak dağıtılır. Wade'in kuralları , yapıları atom sayısı ve aralarındaki bağlantı açısından rasyonelleştirmek için kullanılabilecek güçlü bir yöntem sağlar.
çok kümeli boranlar
Nispeten nadir olmakla birlikte, birkaç çok kümeli boran karakterize edilmiştir. Örneğin B ile bir boran kümesinin Reaksiyon 2 H 6 (bh bir kaynağı olarak 3 : a) oluşumuna yol açabilir conjuncto boran küme alt birimleri bor atomlarının paylaşımı ile birleştirilir ki burada -boran türleri.
- B 6 H 10 + (BH 3 ) → B 7 H 11 + H 2
- B 7 H 11 + B 6 H 10 → B 13 H 19 + H 2
Alt birimlerin bir BB bağı ile birleştirildiği diğer konjonkto- boranlar, nido- boranların ultraviyole ışınlaması ile yapılabilir. Bazı BB bağlanmış conjuncto -boranes pTBR kullanılarak üretilebilir 2 katalizör olarak mevcuttur.
Wade'in Kurallarına benzer şekilde, çok kümeli boranları tahmin etmek veya rasyonelleştirmek için elektron sayma şeması geliştirilmiştir.
| Önek | Anlam | Örnek |
|---|---|---|
| klado - | dallanmış kümeler | |
| konjonkto - | yapışık kümeler | |
| megalo - | çoklu yapışık kümeler |
boranların reaktivitesi
Düşük boran, BH 3 formu diboran, B anında dimerize, sadece geçici olarak mevcut 2 H 6 . BH 3 ·THF ve BH 3 ·DMSO katkı maddeleri , hidroborasyon reaksiyonlarında kullanılmak için yeterince kararlıdır . Diboranın davranışını anımsatan bazı düşük boranlar hava ile çok ekzotermik, hatta patlayıcı reaksiyona girer. Buna karşılık, B 12 H 12 2− gibi birçok kapalı boran kümesi hava ile reaksiyona girmez.
Bor hidrit kümeleri o kadar çeşitlidir ki reaksiyonları hakkında genelleme yapmak mümkün değildir.
Lewis asit/baz davranışı
bazıları, BH terminal gruplarının nispi temel karakteri nedeniyle elektron vericileri olarak işlev görür . Boranlar gibi işlev görebilir ligandlar olarak koordinasyon bileşikleri . Hapticities r | arasında 1 r için 6 BB bağ köprü H atomu ya da bir bağış içeren elektron bağış ile tespit edilmiştir. Örneğin, nido- B 6 H 10 de eten yerine Zeise tuzu (η Fe üretmek için 2 -B 6 H 10 ) (C = O) 4 .
Ayrıca kümenin açılmasıyla birlikte Lewis asitleri olarak da hareket edebilirler . Trimetilfosfin içeren bir örnek :
- B 5 H 9 + 2 PMe 3 → B 5 H 9 (PMe 3 ) 2
Bronsted asit/baz davranışı
Bazı yüksek boranlar, özellikle köprü hidrojen atomlarına sahip olanlar, güçlü bir baz ile protonsuzlaştırılabilir. Bir örnek:
- B 5 H 9 + NaH → Na(B 5 H 8 ) + H 2
Boranın boyutu arttıkça asitlik artar. B 10 H 14'ün pK değeri 2,7'dir.
- B 5 H 9 < B 6 H 10 < B 10 H 14 < B 16 H 20 < B 18 H 22
Aufbau reaksiyonları
Bor hidrit kimyagerleri için en önemli reaksiyonlardan biri, daha küçük bor hidrit kümelerinin daha büyük kümeler vermek üzere boran eklediği oluşturma sürecidir.
hidroborasyon
Diboran ve eklentilerinin davranışını anımsatan yüksek boranlar hidroborasyona katılır. Bor hidritler bir eklerken alkin , karbon üreten küme içine dahil edilmekte Karboranlar , örneğin Cı- 2 B 10 , H 12 .
Uygulamalar
Diboran ve monomerik eklentileri boran-tetrahidrofuran veya boran-dimetilsülfid faydalı reaktiflerdir. Genellikle kullanılan hidroborasyon olarak organik sentez . Daha yüksek bor hidrit kümeleri çok fazla veya herhangi bir uygulama sağlamamıştır. Karboranların bazıları kobalt türevi tutulmasına yönelik ticari olarak üretilmektedir 137 den Cs radyoaktif atıkların .
Aspirasyon kullanımları
Bor hidrit kümeleri, nötronları kolayca emdiğinden, türevleri , kanserin Nötron yakalama terapisindeki uygulamalar için sıklıkla araştırılmıştır . Tercih edilen bir bileşik, Na 2 [B 12 , H 11 (SH)]. 10 B'nin çok yüksek bir nötron yakalama kesitine sahip olduğu gerçeğinden yararlanır , bu nedenle nötron ışıması, bileşiğin bulunduğu bölge için oldukça seçicidir.
- 10 B + 1 n → ( 11 B*) → 4 He + 7 Li + γ (2.4 Mev)
Boranlar, hidrokarbonlara kıyasla yüksek bir özgül yanma enerjisine sahiptir ve bu da onları yakıt olarak potansiyel olarak çekici hale getirir. 1950'lerde jet yakıtı katkı maddeleri olarak kullanımları konusunda yoğun araştırmalar yapıldı , ancak bu çaba uygulanabilir sonuçlara yol açmadı.
Ayrıca bakınız
- Kategori:Boranlar , tüm özel boran bileşikli ürünleri içeren