Vigabatrin - Vigabatrin
 | |
 | |
| Klinik veriler | |
|---|---|
| Ticari isimler | Sabril, Vigadrone |
| Diğer isimler | y-Vinil-GABA |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a610016 |
| Hamilelik kategorisi |
|
Yönetim yolları |
Ağızla |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum | |
| Farmakokinetik veriler | |
| biyoyararlanım | %80–90 |
| Protein bağlama | %0 |
| Metabolizma | metabolize edilmemiş |
| Eliminasyon yarı ömrü | Genç erişkinlerde 5-8 saat, yaşlılarda 12-13 saat. |
| Boşaltım | böbrek |
| tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| IUPHAR/BPS | |
| İlaç Bankası | |
| Kimyasal Örümcek | |
| ÜNİİ | |
| fıçı | |
| CHEMBL | |
| CompTox Panosu ( EPA ) | |
| ECHA Bilgi Kartı |
100.165.122 |
| Kimyasal ve fiziksel veriler | |
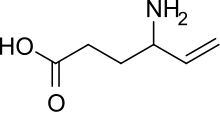
| formül | C 6 H 11 N O 2 |
| Molar kütle | 129.159 g·mol -1 |
| 3B model ( JSmol ) | |
| Erime noktası | 171 - 177 °C (340 - 351 °F) |
| |
| |
| (Doğrulayın) | |
Sabril markası olan Vigabatrin , epilepsi tedavisinde kullanılan bir ilaçtır . 2019 yılında jenerik bir ilaç olarak kullanıma sunuldu .
Bu engelleyerek çalışır arıza ve γ-amino butirik asit (GABA). Bu da bilinir γ-vinil-GABA ve bir yapısal analoğudur GABA ancak bağlanmayan GABA reseptörlerinin .
Tıbbi kullanımlar
Epilepsi
Kanada'da, vigabatrin, tedaviye dirençli (diğer bir ilaçla) bir yardımcı tedavi olarak kullanım için onaylanmıştır epilepsi , kompleks kısmi nöbetler , sekonder genel nöbetler , ve monoterapi kullanım için infantil spazmları içinde West sendromu .
2003 itibariyle, vigabatrin, geleneksel terapi (ek veya monoterapi) ile tatmin edici bir şekilde kontrol edilmeyen epilepsi tedavisi için Meksika'da veya diğer ajanları denememiş (monoterapi) yakın zamanda teşhis edilmiş hastalarda onaylanmıştır.
Vigabatrin ayrıca sekonder jeneralize tonik-klonik nöbetlerde , kısmi nöbetlerde ve West sendromuna bağlı infantil spazmlarda monoterapi kullanımı için endikedir.
21 Ağustos 2009'da Lundbeck, ABD Gıda ve İlaç İdaresi'nin vigabatrin için iki Yeni İlaç Uygulaması onayı verdiğini duyurdu. İlaç, potansiyel faydaların potansiyel görme kaybı riskinden daha ağır bastığı infantil spazmları olan bir aydan iki yaşına kadar olan pediatrik hastalarda monoterapi olarak ve dirençli kompleks parsiyel nöbetleri olan yetişkin hastalarda ek (ek) tedavi olarak endikedir. Birkaç alternatif tedaviye yetersiz yanıt veren ve potansiyel faydaları görme kaybı riskinden daha ağır basan CPS).
1994 yılında Feucht ve Brantner-Inthaler , sodyum valproat ile kötü sonuçlar alan Lennox-Gastaut sendromlu çocukların %85'inde vigabatrinin nöbetleri %50-100 oranında azalttığını bildirmiştir .
Diğerleri
Vigabatrin , sağlıklı gönüllülerde yüksek kortizol ve ACTH seviyelerine ek olarak kolesistokinin tetrapeptid kaynaklı panik bozukluğu semptomlarını azalttı .
Vigabatrin ayrıca , γ-Hidroksibütirik asit ( GHB ) birikimi yoluyla zihinsel engellilik , hipotoni , nöbetler , konuşma bozukluğu ve ataksiye neden olan doğuştan gelen bir GABA metabolizma kusuru olan süksinik semialdehit dehidrojenaz eksikliğindeki (SSADHD) nöbetleri tedavi etmek için kullanılır . Vigabatrin, GABA transaminaz inhibisyonu yoluyla GHB seviyelerini düşürmeye yardımcı olur. Ancak bu sadece beyindedir; periferik GABA transaminaz üzerinde hiçbir etkisi yoktur, bu nedenle GHB birikmeye devam eder ve sonunda beyne ulaşır.
Yan etkiler
Merkezi sinir sistemi
Uykululuk (%12.5), baş ağrısı (%3.8), baş dönmesi (%3.8), sinirlilik (%2.7), depresyon (%2.5), hafıza bozuklukları (%2.3), çift görme (%2.2), saldırganlık (%2.0), ataksi (%1.9), vertigo (%1.9), hiperaktivite (%1.8), görme kaybı (%1.6) (aşağıya bakınız), kafa karışıklığı (%1.4), uykusuzluk (%1.3), konsantrasyon bozukluğu (%1.2), kişilik sorunları ( %1,1). 299 çocuktan 33'ü (%11) hiperaktif hale geldi.
Bazı hastalarda vigabatrin tedavisi sırasında, yetişkinlerde çocuklardan daha sık görülen psikoz gelişir . Bu, daha önce psikoz öyküsü olmayan hastalarda bile olabilir. Diğer nadir CNS yan etkileri arasında kaygı, duygusal kararsızlık , sinirlilik, titreme, anormal yürüyüş ve konuşma bozukluğu yer alır .
gastrointestinal
Karın ağrısı (%1.6), kabızlık (%1.4), kusma (%1.4) ve bulantı (%1.4). Klinik çalışmalarda deneklerin %1'inden azında dispepsi ve iştah artışı görülmüştür.
Bir bütün olarak vücut
Yorgunluk (%9.2), kilo alma (%5.0), asteni (%1.1).
teratojenite
Tavşanlarda yapılan bir teratoloji çalışmasında, 150 mg/kg/gün dozun yavruların %2'sinde yarık damak , 200 mg/kg/gün dozun ise %9'una neden olduğu bulunmuştur. Bunun nedeni Mart 2001'de yayınlanan bir araştırmaya göre metiyonin seviyelerindeki düşüş olabilir . 2005 yılında Catania Üniversitesi'nde yapılan bir araştırma, anneleri 250-1000 mg/kg/gün tüketen sıçanların daha zayıf olduğunu belirten bir çalışma yayınladı. su labirenti ve açık alan görevlerindeki performans , 750 mg grubundaki sıçanlar doğumda zayıftı ve kontrol grubuna yetişemedi ve 1000 mg grubundaki sıçanlar gebelik yaşamadı.
Bugüne kadar insanlarda kontrollü teratoloji verisi yoktur.
Duyusal
2003 yılında, vigabatrin geri dönüşü olmayan yaygın neden Frisen ve Malmgren ile gösterilmiştir atrofi ve retina sinir lifi bir katman retrospektif 25 hasta çalışma. Bu, retinanın dış alanı ( maküler veya merkezi alanın aksine) üzerinde en fazla etkiye sahiptir . Görme alanı kusurları 1997 gibi erken bir tarihte Tom Eke ve Birleşik Krallık'taki diğerleri tarafından rapor edilmişti. Comaish ve diğerleri dahil olmak üzere bazı yazarlar. Vigabatrin kullanıcılarının %50'sine kadar görme alanı kaybının ve elektrofizyolojik değişikliklerin kanıtlanabileceğine inanmaktadır.
Vigabatrinin retinal toksisitesi, bir taurin tükenmesine bağlanabilir .
Güvenlik sorunları nedeniyle , FDA tarafından Vigabatrin REMS Programının, başlamadan önce bilinçli kararlar alınmasını ve bu ilacın uygun şekilde kullanılmasını zorunlu kılmaktadır .
Etkileşimler
2002'de yayınlanan bir çalışma, vigabatrinin karbamazepinin plazma klerensinde istatistiksel olarak anlamlı bir artışa neden olduğunu buldu .
1984'te Galler Üniversitesi'nden Drs Rimmer ve Richens, tedaviye dirençli epilepsili hastalarda vigabatrin ile fenitoin uygulanmasının serum fenitoin konsantrasyonunu düşürdüğünü bildirdi . Beş yıl sonra, aynı iki bilim adamı, bu etkileşimin arkasındaki mekanizmayı aydınlatmaya yönelik başarısız girişimlerini açıklayan bir makalede, beş hafta içinde fenitoin konsantrasyonunda %23'lük bir düşüş bildirdiler.
Farmakoloji
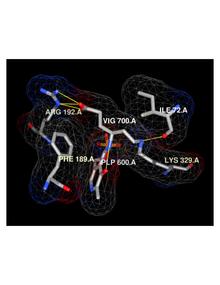
Vigabatrin bir geri döndürülemez bir mekanizma bazlı inhibitörünün bir gama-aminobutirik asit aminotransferaz (GABA-AT), enzim sorumludur katabolizması ve GABA . GABA-AT'nin inhibisyonu , beyindeki GABA düzeylerinin artmasına neden olur . Vigabatrin rasemik bir bileşiktir ve [S]- enantiyomeri farmakolojik olarak aktiftir. ,
farmakokinetik
Çoğu ilaçta, eliminasyon yarı ömrü, dozlama çizelgelerinin ve kararlı durum konsantrasyonlarına ulaşmak için gereken zamanın yararlı bir tahmincisidir . Ancak vigabatrin durumunda biyolojik aktivitenin yarı ömrünün eliminasyon yarı ömründen çok daha uzun olduğu bulunmuştur.
Vigabatrin için hedef konsantrasyon aralığı yoktur çünkü araştırmacılar yanıt verenlerin ve yanıt vermeyenlerin serum konsantrasyon seviyeleri arasında hiçbir fark bulamamışlardır. Bunun yerine, etki süresinin daha çok GABA-T yeniden sentez hızının bir fonksiyonu olduğuna inanılmaktadır; GABA-T seviyeleri, ilacı bıraktıktan altı gün sonraya kadar genellikle normal durumlarına dönmez.
Tarih
Vigabatrin, epileptik bir nöbeti durdurmak için beyindeki GABA konsantrasyonlarını arttırma özel hedefi ile 1980'lerde geliştirilmiştir. Bunu yapmak için ilaç, GABA substratını bozan GABA transaminazını geri dönüşümsüz olarak inhibe edecek şekilde tasarlanmıştır. İlaç 1989'da Birleşik Krallık'ta tedavi için onaylanmış olmasına rağmen, ABD Gıda ve İlaç İdaresi tarafından Vigabatrin'in izinli kullanımı 2009'dan önce Amerika Birleşik Devletleri'nde iki kez ertelendi. Hayvan deneylerinde intramiyelinizan ödem ürettiği için 1983'te ertelendi, ancak Etkiler insan denemelerinde belirgin değildi, bu nedenle ilaç tasarımı devam etti. 1997'de, insanlarda çevresel görme alanı kusurlarıyla bağlantılı olduğu için denemeler geçici olarak askıya alındı.
Toplum ve kültür
Marka isimleri
Vigabatrin Kanada, Meksika ve Birleşik Krallık'ta Sabril olarak satılmaktadır. Danimarka'daki marka adı Sabrilex'tir. Sabril, 21 Ağustos 2009'da Amerika Birleşik Devletleri'nde onaylandı ve ABD'de Mart 2009'da ABD sponsoru Ovation Pharmaceuticals'ı satın alan Lundbeck Inc. tarafından pazarlandı.
Genel eşdeğerler
16 Ocak 2019'da Gıda ve İlaç İdaresi , Sabril'in (vigabatrin) Amerika Birleşik Devletleri'ndeki ilk jenerik versiyonunu onayladı.
Referanslar
Dış bağlantılar
- "Vigabatrin" . İlaç Bilgi Portalı . ABD Ulusal Tıp Kütüphanesi.