değerlik elektronu - Valence electron

Gelen kimya ve fizik , bir valans elektronu bir bir elektron dış bölgesindeki kabuğu , bir ilişkili atomu , ve bu oluşum katılabilir kimyasal bağ dış kabuk kapalı olup olmadığı; tek bir kovalent bağda , bağdaki her iki atom ortak bir çift oluşturmak için bir değerlik elektronuna katkıda bulunur .
Belirleyebilir valans elektronlarının varlığı elemanı 's , kimyasal , örneğin onun gibi özellikleri valans o kadar, nasıl kolayca ve kaç ile, diğer elemanları ile bir bağ olabilir ve-ister. Bu şekilde, belirli bir elemanın reaktivitesi, elektronik konfigürasyonuna büyük ölçüde bağlıdır. Bir ana grup elemanı için , bir değerlik elektronu yalnızca en dıştaki elektron kabuğunda bulunabilir ; bir geçiş metali için , bir değerlik elektronu da bir iç kabukta olabilir.
Kapalı bir değerlik elektronları kabuğuna sahip bir atom ( soy gaz konfigürasyonuna karşılık gelir ) kimyasal olarak inert olma eğilimindedir . Bir veya iki değerlik elektronu kapalı bir kabuktan daha fazla olan atomlar, pozitif bir iyon oluşturmak için ekstra değerlik elektronlarını çıkarmak için nispeten düşük enerji nedeniyle oldukça reaktiftir . Kapalı bir kabuktan bir veya iki elektronu daha az olan bir atom, ya eksik değerlik elektronlarını kazanma ve negatif bir iyon oluşturma ya da değerlik elektronlarını paylaşma ve bir kovalent bağ oluşturma eğilimi nedeniyle reaktiftir.
Bir çekirdek elektrona benzer şekilde , bir değerlik elektronu, bir foton formundaki enerjiyi emme veya salma yeteneğine sahiptir . Bir enerji kazanımı, elektronun bir dış kabuğa hareket etmesini (sıçramasını) tetikleyebilir; bu atomik uyarılma olarak bilinir . Veya elektron, ilişkili atomun kabuğundan bile kopabilir; Bu, pozitif bir iyon oluşturmak için iyonlaşmadır . Bir elektron enerji kaybettiğinde (böylece bir fotonun yayılmasına neden olur), o zaman tamamen dolu olmayan bir iç kabuğa geçebilir.
genel bakış
Elektron konfigürasyonu
Değerliliği - bir atomun kimyasal olarak nasıl tepki verdiğini - belirleyen elektronlar , en yüksek enerjiye sahip olanlardır .
Bir ana grup elemanı için , değerlik elektronları, en yüksek ana kuantum sayısı n olan elektronik kabukta bulunan elektronlar olarak tanımlanır . Bu nedenle, sahip olabileceği değerlik elektronlarının sayısı, elektron konfigürasyonuna basit bir şekilde bağlıdır. Örneğin, fosforun (P) elektronik konfigürasyonu 1s 2 2s 2 2p 6 3s 2 3p 3'tür, böylece 5 değerlik elektronu vardır (3s 2 3p 3 ), PF molekülünde olduğu gibi P için maksimum değer 5'e tekabül eder. 5 ; bu konfigürasyon normalde [Ne] 3s 2 3p 3 olarak kısaltılır , burada [Ne], konfigürasyonu soy gaz neonununkiyle aynı olan çekirdek elektronları belirtir .
Bununla birlikte, geçiş elemanları , enerjileri n s düzeyine çok yakın olan ( n −1)d enerji seviyelerine kısmen sahiptir . Bu nedenle, ana grup elementlerinin aksine, bir geçiş metali için bir değerlik elektronu, bir soy gaz çekirdeğinin dışında bulunan bir elektron olarak tanımlanır. Bu nedenle, genellikle geçiş metallerindeki d elektronları, en dış kabukta olmasalar da değerlik elektronları gibi davranırlar. Örneğin, manganez (Mn), 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 konfigürasyonuna sahiptir ; bu [Ar] 4s 2 3d 5 olarak kısaltılır , burada [Ar] soy gaz argonununkiyle aynı olan bir çekirdek konfigürasyonunu belirtir . Bu atomda 3 boyutlu bir elektron, 4s elektronununkine benzer ve 3s veya 3p elektronundan çok daha yüksek enerjiye sahiptir. Gerçekte , argon benzeri çekirdeğin dışında muhtemelen yedi değerlik elektronu (4s 2 3d 5 ) vardır; bu, manganezin +7 kadar yüksek bir oksidasyon durumuna sahip olabileceği kimyasal gerçeğiyle tutarlıdır ( permanganat iyonunda: MnO-
4).
Her geçiş metali serisinde ne kadar sağda olursa, alt kabuktaki bir elektronun enerjisi o kadar düşük olur ve böyle bir elektronun değerlik özellikleri o kadar az olur. Bu nedenle, bir nikel atomunun prensipte on değerlik elektronu (4s 2 3d 8 ) olmasına rağmen , oksidasyon durumu asla dördü geçmez. İçin çinko bazı bileşiklerde valans katkı olmasına rağmen, 3d alt kabuk, bilinen tüm bileşikler içinde tamamlanır.
D elektron sayısı bir geçiş metali kimyası anlamak için alternatif bir araçtır.
Değerlik elektronlarının sayısı
Bir elementin değerlik elektronlarının sayısı , elementin kategorize edildiği periyodik tablo grubu (dikey sütun) ile belirlenebilir . 3-12 grupları ( geçiş metalleri ) dışında, grup numarasının birimler basamağı, o sütun altında listelenen bir elementin nötr atomuyla kaç değerlik elektronunun ilişkili olduğunu tanımlar.
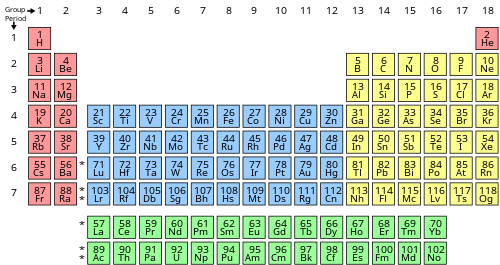
| Periyodik tablo bloğu | Periyodik tablo grubu | değerlik elektronları |
|---|---|---|
| s | Grup 1 (I) ( alkali metaller ) | 1 |
| Grup 2 (II) ( toprak alkali metaller ) ve helyum | 2 | |
| F | Lantanitler ve aktinitler | 3-16 |
| NS | Grup 3-12 ( geçiş metalleri ) | 3–12 |
| P | Grup 13 (III) ( bor grubu ) | 3 |
| Grup 14 (IV) ( karbon grubu ) | 4 | |
| Grup 15 (V) ( pniktojenler veya azot grubu) | 5 | |
| Grup 16 (VI) ( kalkojenler veya oksijen grubu) | 6 | |
| Grup 17 (VII) ( halojenler ) | 7 | |
| Helyum hariç Grup 18 (VIII veya 0) ( soy gazlar ) | 8 |
Helyum bir istisnadır: 1s olmasına rağmen 2 , iki valans elektronu olan konfigürasyon ve böylece, toprak alkali metalleri ile bazı benzerlikler olan n s 2 değerlikli yapılandırmaları olarak, kabuk tamamen dolu ve dolayısıyla çok atıl kimyasal ve genellikle yerleştirilir 18. grupta diğer soy gazlarla birlikte.
değerlik kabuğu
Değerlik kabuğu, kimyasal bağlar oluşturmak için elektronları kabul etmek için enerjisel olarak erişilebilen orbitaller kümesidir .
Ana grup elemanları için değerlik kabuğu , en dıştaki elektron kabuğundaki n s ve n p orbitallerinden oluşur . İçin geçiş metalleri arasında orbitalleri tam olmayan ( n -1) d alt kabuk dahildir ve için lantanidler ve aktinidlerden tam olmayan ( N -2), f ve ( n -1) d altkabuklarda. İlgili orbitaller bir iç elektron kabuğunda olabilir ve hepsi belirli bir elementteki aynı elektron kabuğuna veya temel kuantum sayısına n karşılık gelmez , ancak hepsi çekirdekten benzer mesafelerdedir.
| Öğe türü | Hidrojen ve helyum | p-blok ( ana grup elemanları ) |
d-blok ( Geçiş metalleri ) |
f bloğu ( Lantanitler ve aktinitler ) |
|---|---|---|---|---|
| değerlik orbitalleri |
|
|
|
|
| Elektron sayma kuralları | Düet/Duplet kuralı | sekizli kuralı | 18 elektron kuralı | 32 elektron kuralı |
Genel bir kural olarak, bir ana grup elementi (hidrojen veya helyum hariç) 2 p 6 elektron konfigürasyonu olarak reaksiyona girme eğilimindedir . Bu eğilime oktet kuralı denir , çünkü bağlı her atom, paylaşılan elektronlar dahil olmak üzere 8 değerlik elektronuna sahiptir. Benzer şekilde, bir geçiş metali 10 s 2 p 6 elektron konfigürasyonu oluşturmak üzere reaksiyona girme eğilimindedir . Bu eğilime 18 elektron kuralı denir , çünkü bağlı her atom, paylaşılan elektronlar dahil 18 değerlik elektronuna sahiptir.
kimyasal reaksiyonlar
Bir atomdaki değerlik elektronlarının sayısı, onun bağlanma davranışını yönetir . Bu nedenle, atomları aynı sayıda değerlik elektronuna sahip olabilen elementler, elementlerin periyodik tablosunda birlikte gruplanır .
Metalik elementin en reaktif türü, grup 1'in bir alkali metalidir (örneğin, sodyum veya potasyum ); bunun nedeni, böyle bir atomun yalnızca tek bir değerlik elektronuna sahip olmasıdır; gerekli iyonlaşma enerjisini sağlayan bir iyonik bağın oluşumu sırasında , bu bir değerlik elektronu, kapalı bir kabuk (örn., Na + veya K + ) ile pozitif bir iyon (katyon) oluşturmak için kolayca kaybolur . Grup 2'nin bir alkali toprak metali (örneğin magnezyum ) biraz daha az reaktiftir, çünkü her atomun kapalı bir kabukla (örneğin, Mg2 + ) pozitif bir iyon oluşturmak için iki değerlik elektronunu kaybetmesi gerekir .
Metallerin her bir grubu (her bir periyodik tablo sütunu) içinde, tablonun her alt sırası ile (hafif bir elementten daha ağır bir elemente doğru) reaktivite artar, çünkü daha ağır bir element, daha hafif bir elementten daha fazla elektron kabuğuna sahiptir; daha ağır bir elementin değerlik elektronları daha yüksek temel kuantum sayılarında bulunur (atomun çekirdeğinden daha uzaktadırlar ve bu nedenle daha yüksek potansiyel enerjilerdedirler, bu da daha az sıkı bağlı oldukları anlamına gelir).
Bir metal olmayan atom, bir tam valans kabuk elde etmek için ek bir valans elektronları çekmek eğilimindedir; bu iki yoldan biriyle elde edilebilir: Bir atom ya komşu bir atomla elektronları paylaşabilir ( kovalent bağ ) ya da başka bir atomdan elektronları çıkarabilir ( iyonik bağ ). Ametal elementin en reaktif türü bir halojendir (örneğin, florin (F) veya klorin (Cl)). Böyle bir atom aşağıdaki elektron konfigürasyonuna sahiptir: s 2 p 5 ; bu, kapalı bir kabuk oluşturmak için yalnızca bir ek değerlik elektronu gerektirir. İyonik bir bağ oluşturmak için, bir halojen atomu, bir anyon oluşturmak için başka bir atomdan bir elektron çıkarabilir (örneğin, F - , Cl - , vb.). Bir kovalent bağ oluşturmak için, halojenden bir elektron ve başka bir atomdan bir elektron ortak bir çift oluşturur (örneğin, H-F molekülünde çizgi, biri H'den diğeri F'den olmak üzere paylaşılan bir değerlik elektron çiftini temsil eder).
Ametallerin her grubu içinde, valans elektronları giderek daha yüksek enerjilerde olduğundan ve dolayısıyla giderek daha az sıkı bağlı olduğundan, tablonun her alt satırında (hafif bir elementten ağır bir elemente) reaktivite azalır. Aslında oksijen (grup 16'daki en hafif element), bir halojen olmasa da, flordan sonra en reaktif ametaldir, çünkü bir halojenin değerlik kabuğu daha yüksek bir temel kuantum sayısındadır.
Oktet kuralına uyulan bu basit durumlarda , bir atomun değerliliği , kararlı sekizli oluşturmak için kazanılan, kaybedilen veya paylaşılan elektronların sayısına eşittir. Bununla birlikte, istisna olan ve değerliklerinin daha az net bir şekilde tanımlandığı birçok molekül de vardır .
Elektiriksel iletkenlik
Değerlik elektronları, bir elementin elektriksel iletkenliğinden de sorumludur ; sonuç olarak, bir element metal , ametal veya yarı iletken (veya metaloid ) olarak sınıflandırılabilir .
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grup → | ||||||||||||||||||||||||||||||||
| ↓ Dönem | ||||||||||||||||||||||||||||||||
| 1 | H | o | ||||||||||||||||||||||||||||||
| 2 | Li | olmak | B | C | n | Ö | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | CA | sc | Ti | V | cr | Mn | Fe | ortak | Ni | Cu | çinko | ga | Ge | Olarak | Gör | Br | Kr | ||||||||||||||
| 5 | Rb | Bay | Y | Zr | not | ay | Tc | Ru | Rh | PD | Ag | CD | İçinde | Sn | Sb | Te | ben | Xe | ||||||||||||||
| 6 | C'ler | Ba | La | CE | Halkla İlişkiler | Nd | Öğleden sonra | Sm | AB | gd | yemek | dy | Ho | Er | Tm | yb | lu | hf | Ta | W | Tekrar | İşletim sistemi | ir | nokta | Au | Hg | TL | Pb | Bi | po | NS | Rn |
| 7 | Cum | Ra | AC | NS | baba | sen | np | Pu | NS | Santimetre | bk | bkz. | Es | FM | md | Numara | lr | Rf | db | Çavuş | bh | hs | dağ | Ds | Rg | Müşteri | Nh | fl | Mc | Sv. | Ts | og |
|
|
||||||||||||||||||||||||||||||||
|
Metal metaloid ametal Bilinmeyen özellikler Arka plan rengi , periyodik tablodaki metal-metaloid-ametal eğilimini gösterir |
||||||||||||||||||||||||||||||||
Metalik elementler , katı haldeyken genellikle yüksek elektrik iletkenliğine sahiptir . Periyodik tablonun her satırında metaller, ametallerin solunda yer alır ve bu nedenle bir metal, ametalden daha az olası değerlik elektronuna sahiptir. Bununla birlikte, bir metal atomunun değerlik elektronu küçük bir iyonlaşma enerjisine sahiptir ve katı halde bu değerlik elektronu, yakındaki başka bir atomla ilişki kurmak için bir atomu terk etmekte nispeten serbesttir. Böyle bir "serbest" elektron, bir elektrik alanının etkisi altında hareket ettirilebilir ve hareketi bir elektrik akımı oluşturur ; metalin elektriksel iletkenliğinden sorumludur. Bakır , alüminyum , gümüş ve altın iyi iletken örnekleridir.
Bir metalik olmayan elemanı, düşük bir elektrik iletkenliğine sahiptir; yalıtkan görevi görür . Böyle bir element, periyodik tablonun sağ tarafında bulunur ve en az yarısı dolu bir değerlik kabuğuna sahiptir (istisna bor'dur ). İyonlaşma enerjisi büyüktür; bir elektrik alanı uygulandığında bir elektron atomu kolayca terk edemez ve bu nedenle böyle bir element sadece çok küçük elektrik akımları iletebilir. Katı element izolatörlerin örnekleri, elmas (bir Allotrop arasında karbon ) ve kükürt .
Metal atomlarının değerlik elektronları iyonik bağlar oluşturmak için kullanılıyorsa, metal içeren katı bir bileşik de bir yalıtkan olabilir . Örneğin, elementel sodyum bir metal olmasına rağmen , katı sodyum klorür bir yalıtkandır, çünkü sodyumun değerlik elektronu bir iyonik bağ oluşturmak üzere klora aktarılır ve bu nedenle elektron kolayca hareket ettirilemez.
Bir yarı iletken , bir metal ile ametal arasında bir elektrik iletkenliğine sahiptir; bir yarı iletken ayrıca bir metalden, bir yarı iletkenin iletkenliğinin sıcaklıkla artması bakımından farklıdır . Tipik temel yarı iletkenler , her bir atomu dört değerlik elektronuna sahip olan silikon ve germanyumdur . Yarı iletkenlerin özellikleri en iyi şekilde , bir değerlik bandı (mutlak sıfırda değerlik elektronlarını içerir) ile bir iletkenlik bandı (değerlik elektronlarının termal enerji tarafından uyarıldığı ) arasındaki küçük bir enerji boşluğunun bir sonucu olarak, bant teorisi kullanılarak açıklanır .
Referanslar
Dış bağlantılar
- Francis, Eden. Değerlik Elektronları .
