sitagliptin - Sitagliptin
 | |
 | |
| Klinik veriler | |
|---|---|
| Telaffuz |
/ S ɪ t ə ɡ l ɪ s t ɪ n / ( dinleme ) |
| Ticari isimler | Januvia, Tesavel, Xelevia, diğerleri |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a606023 |
| Lisans verileri | |
| Hamilelik kategorisi |
|
Yönetim yolları |
Ağızla |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum | |
| Farmakokinetik veriler | |
| biyoyararlanım | %87 |
| Protein bağlama | %38 |
| Metabolizma | Karaciğer ( CYP3A4 - ve CYP2C8 - aracılı) |
| Eliminasyon yarı ömrü | 8 ila 14 saat |
| Boşaltım | Böbrek (%80) |
| tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| IUPHAR/BPS | |
| İlaç Bankası | |
| Kimyasal Örümcek | |
| ÜNİİ | |
| fıçı | |
| chebi | |
| CHEMBL | |
| CompTox Panosu ( EPA ) | |
| ECHA Bilgi Kartı |
100.217.948 |
| Kimyasal ve fiziksel veriler | |
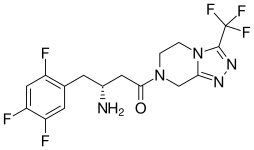
| formül | C 16 H 15 F 6 N 5 O |
| Molar kütle | 407.320 g·mol -1 |
| 3B model ( JSmol ) | |
| |
| |
| (Doğrulayın) | |
Diğerleri arasında Januvia markası altında satılan Sitagliptin , tip 2 diyabet tedavisinde kullanılan bir anti-diyabetik ilaçtır . Birleşik Krallık'ta metformin veya bir sülfonilüreden daha az tercih edilen olarak listelenmiştir . Ağızdan alınır . Aynı zamanda sabit doz kombinasyonlu ilaç sitagliptin/metformin (Janumet, Janumet XR) olarak da mevcuttur.
Yaygın yan etkiler arasında baş ağrısı, bacaklarda şişme ve üst solunum yolu enfeksiyonları bulunur . Ciddi yan etkiler arasında anjiyoödem , düşük kan şekeri , böbrek sorunları , pankreatit ve eklem ağrısı sayılabilir . Kullanım İster hamilelik veya emzirme güvenlidir belirsizdir. Bu olan dipeptidil peptidaz-4 (DPP-4) inhibitörü üretimini arttırarak sınıf ve eser insülin ve üretimini azaltarak glukagon pankreas tarafından.
Sitagliptin, Merck & Co. tarafından geliştirildi ve 2006 yılında Amerika Birleşik Devletleri'nde tıbbi kullanım için onaylandı. 2019'da, 8 milyondan fazla reçete ile Amerika Birleşik Devletleri'nde en sık reçete edilen 88. ilaç oldu .
Tıbbi kullanımlar
Sitagliptin, tip 2 diyabet tedavisinde kullanılır. Genellikle metformin veya sülfonilürelerden daha az tercih edilir . Ağızdan alınır. Ayrıca olarak mevcuttur sabit doz kombinasyonları arasında sitagliptin / metformin (Janumet, Janumet XR) ve sitagliptin / simvastatin (Juvisync).
Sitagliptin, tip 1 diyabet tedavisinde kullanılmamalıdır. Aralık 2020'de ABD Gıda ve İlaç Dairesi (FDA), Januvia (sitagliptin), Janumet (sitagliptin ve metformin hidroklorür) ve Janumet XR'nin (sitagliptin ve metformin hidroklorür uzatılmış salımı) glisemiyi iyileştirdiğinin kanıtlanmadığını belirten etiketleme değişikliklerini onayladı ( Tip 2 diyabetli 10-17 yaş arası çocuklarda kan şekeri) kontrolü. İlaçlar, tip 2 diyabetli 18 yaş ve üstü yetişkinlerde kan şekeri kontrolünü iyileştirmek için onaylanmıştır.
Yan etkiler
Sitagliptinin yan etkileri, nadir görülen mide bulantısı , soğuk algınlığı benzeri semptomlar ve ışığa duyarlılık dışında plaseboya benzer . İshal riskini artırmaz. Resim anlamlı bir fark meydana bulunmaktadır hipoglisemi plasebo ve sitagliptin arasındadır. Sülfonilüre kullananlarda kan şekeri düşüklüğü riski artar.
Birleşik Devletler reçeteleme bilgilerinde böbrek yetmezliği ve aşırı duyarlılık reaksiyonlarına ilişkin nadir vaka raporlarının varlığı belirtilmiştir, ancak sitagliptin için nedensel bir rol belirlenmemiştir.
Çeşitli pazarlama sonrası raporlar arasında pankreatit (bazı ölümcül) sitagliptin ve diğer DPP-4 inhibitörleri ile tedavi edilen kişilerde yapılan ve sitagliptin ve pankreatit arasındaki nedensel bağlantı henüz tam olarak ispatlanmamıştır rağmen ABD prospektüs, bu yöndeki bir uyarı taşır edilmiş . 2009 yılında yayınlanan laboratuar fareleri ile yapılan bir çalışma, metformin ile birlikte kullanıldığında bazı olası pankreatit veya pankreas kanseri risklerinin azaltılabileceği sonucuna varmıştır. Ancak DPP-4 inhibitörleri bu tür risk faktörlerinde artış gösterirken, 2009 yılı itibariyle DPP-4 inhibitörleri kullanan kişilerde pankreas kanserinde artış bildirilmemiştir.
2015 yılında ABD Gıda ve İlaç Dairesi (FDA), tüm DPP-4 inhibitör ilaçlarının etiketlerine "şiddetli ve sakatlayıcı" eklem ağrısı riski hakkında yeni bir uyarı ve önlem ekledi.
Hareket mekanizması
Sitagliptin , dipeptidil peptidaz 4 (DPP-4) enzimini rekabetçi bir şekilde inhibe etmek için çalışır . Bu enzim , bir yemeğe yanıt olarak salınan gastrointestinal hormonlar olan GLP-1 ve GIP inkretinlerini parçalar . GLP-1 ve GIP'nin parçalanmasını önleyerek, insülin salgılanmasını artırabilir ve pankreasın alfa hücreleri tarafından glukagon salınımını baskılayabilirler. Bu, kan şekeri seviyelerini normale doğru yönlendirir. Kan şekeri seviyesi normale yaklaştıkça, salınan insülin ve baskılanan glukagon miktarları azalır, böylece diğer bazı oral hipoglisemik ajanlarda görülen bir "aşımı" ve ardından düşük kan şekerini (hipoglisemi) önleme eğilimi gösterir.
Sitagliptin'in plaseboya kıyasla HbA1c seviyesini yaklaşık %0.7 puan düşürdüğü gösterilmiştir . Monoterapi olarak kullanıldığında metforminden biraz daha az etkilidir . Kilo alımına neden olmaz ve sülfonilürelere göre daha az hipoglisemiye sahiptir. Diyet/egzersiz ve metformin kombinasyonu başarısız olduktan sonra sitagliptin ikinci basamak ilaç olarak (diğer ilaçlarla kombinasyon halinde) önerilir.
Tarih
Sitagliptin, 17 Ekim 2006'da ABD Gıda ve İlaç Dairesi tarafından onaylandı ve ABD'de Merck & Co tarafından Januvia olarak pazarlandı. 2 Nisan 2007'de FDA , ABD'de şu şekilde pazarlanan sitagliptin/metforminin oral bir kombinasyonunu onayladı . Janumet. 7 Ekim 2011'de FDA , ABD'de Juvisync olarak pazarlanan sitagliptin/simvastatinin oral bir kombinasyonunu onayladı .
Referanslar
Dış bağlantılar
- "Sitagliptin" . İlaç Bilgi Portalı . ABD Ulusal Tıp Kütüphanesi.
- "Sitagliptin fosfat" . İlaç Bilgi Portalı . ABD Ulusal Tıp Kütüphanesi.
