fizisorpsiyon - Physisorption
Fiziksel adsorpsiyon olarak da adlandırılan fizisorpsiyon , atom veya molekülün elektronik yapısının adsorpsiyon üzerine zorlukla bozulduğu bir süreçtir .
genel bakış
Fiziksel adsorpsiyonun temel etkileşim kuvveti Van der Waals kuvvetidir . Etkileşim enerjisi çok zayıf olmasına rağmen (~10–100 meV), fizisorpsiyon doğada önemli bir rol oynar. Örneğin , kertenkelelerin yüzeyleri ve ayak kılları arasındaki van der Waals çekiciliği (bkz. Sentetik kıllar ) dikey duvarlara tırmanmak için olağanüstü bir yetenek sağlar. Van der Waals kuvvetleri, indüklenmiş, kalıcı veya geçici elektrik dipolleri arasındaki etkileşimlerden kaynaklanır.
Bağlanan atomların veya moleküllerin elektronik yapısının değiştirildiği ve kovalent veya iyonik bağların oluştuğu kimyasal adsorpsiyon ile karşılaştırıldığında , fizisorpsiyon kimyasal bağ yapısında değişikliklere neden olmaz. Pratikte, belirli bir adsorpsiyonun fizisorpsiyon veya kimyasal adsorpsiyon olarak sınıflandırılması, temel olarak adsorbat maddenin substrata bağlanma enerjisine bağlıdır , fizisorpsiyon atom başına bazında kimyasal bir bağ içeren herhangi bir bağlantı türünden çok daha zayıftır.
Görüntü ücreti ile modelleme
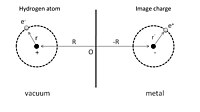
Fiziksel soğurumun basit bir örneğini vermek için, ilk olarak Şekil 1'de gösterildiği gibi mükemmel bir iletkenin önünde adsorbe edilmiş bir hidrojen atomunu düşünebiliriz. R = (0, 0, Z ) noktasında pozitif yüklü bir çekirdek bulunur ve elektronunun konum koordinatı, r = ( x , y , z ) çekirdeğe göre verilir. Adsorpsiyon işlemi, bu hidrojen atomu ile iletkendeki hem çekirdek hem de elektronun görüntü yükleri arasındaki etkileşim olarak görülebilir. Sonuç olarak, toplam elektrostatik enerji, çekim ve itme terimlerinin toplamıdır:
İlk terim, çekirdeğin ve görüntü yükünün çekici etkileşimidir ve ikinci terim, elektron ve görüntü yükünün etkileşiminden kaynaklanır. İtici etkileşim, sırasıyla çekirdek ile görüntü elektronu arasındaki etkileşimden ve elektron ile görüntü çekirdeği arasındaki etkileşimden kaynaklanan üçüncü ve dördüncü terimlerde gösterilir.
By Taylor açılımı kuvvetleri cinsinden | r | / | R |, bu etkileşim enerjisi ayrıca şu şekilde ifade edilebilir:
İlk kaybolmayan terimden, fizisorpsiyon potansiyelinin, adsorplanan atom ile yüzey arasındaki Z mesafesine Z- 3 olarak bağlı olduğu, moleküler van der Waals potansiyelinin r- 6 bağımlılığının aksine , burada r'nin mesafe olduğu bulunabilir. iki dipol arasındadır .
Kuantum-mekanik osilatör ile modelleme
Waals der Van bağlanma enerjisi başka bir basit fiziksel görüntü analiz edilebilir: üç boyutlu bir basit tarafından çekirdek çevresinde bir elektronun hareketini modelleme harmonik osilatör bir potansiyel enerji ile V a :
burada m e ve ω sırasıyla elektronun kütlesi ve titreşim frekansıdır.
Bu atom bir metalin yüzeyine yaklaştığında ve adsorpsiyon oluşturduğunda, bu potansiyel enerji V a , yer değiştirmelerde ikinci dereceden olan ek potansiyel terimler tarafından görüntü yüklerinden dolayı değiştirilecektir:
- (yukarıdaki Taylor açılımından.)
varsayarsak
potansiyel olarak iyi yaklaşık olarak
- ,
nerede
Elektronun temel durumda olduğu varsayılırsa, o zaman van der Waals bağlanma enerjisi esasen sıfır noktası enerjisinin değişimidir:
Bu ifade aynı zamanda van der Waals etkileşiminin Z- 3 bağımlılığının doğasını da gösterir .
Ayrıca, atomik polarize edilebilirliği tanıtarak ,
van der Waals potansiyeli daha da basitleştirilebilir:
nerede
atomik polarizasyonla ilgili olan van der Waals sabitidir.
Ayrıca, yukarıdaki Taylor açılımındaki dördüncü mertebeden düzeltmeyi ( aC v Z 0 ) / (Z 4 ) olarak ifade ederek , a'nın bir sabit olduğu durumlarda , Z 0'ı dinamik görüntü düzleminin konumu olarak tanımlayabilir ve elde edebiliriz.
| o | Ne | Ar | Kr | Xe | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| C v | Z 0 | C v | Z 0 | C v | Z 0 | C v | Z 0 | C v | Z 0 | |
| Cu | 0.225 | 0.22 | 0.452 | 0.21 | 1.501 | 0.26 | 2.11 | 0.27 | 3.085 | 0.29 |
| Ag | 0.249 | 0,2 | 0,502 | 0.19 | 1.623 | 0.24 | 2.263 | 0.25 | 3.277 | 0.27 |
| Au | 0.274 | 0.16 | 0.554 | 0.15 | 1.768 | 0.19 | 2.455 | 0,2 | 3.533 | 0.22 |
Z 0'ın kaynağı , elektron dalga fonksiyonunun yüzeyden dökülmesinden gelir. Bunun bir sonucu olarak, uzay koordinat referans temsil görüntü düzleminin konumu alt-tabaka yüzeyinin kendisinden farklı olabilir ve modifiye edilen Z 0 .
Tablo 1, çeşitli metal yüzeyler üzerindeki nadir gaz atomlarının van der Waals sabiti C v ve dinamik görüntü düzlemi Z 0 için jellium modeli hesaplamasını gösterir . Artan Cı v tüm metal substratlar için Xe He den daha büyük atom neden olduğu polarize ağır nadir gaz atomlarının. Dinamik görüntü düzleminin konumu için, artan dielektrik fonksiyonu ile azalır ve tipik olarak 0,2 Å düzeyindedir.
fizisorpsiyon potansiyeli
Van der Waals etkileşimi çekici olsa da , adsorbe edilen atom yüzeye yaklaştıkça elektronun dalga fonksiyonu yüzey atomlarınınkiyle örtüşmeye başlar. Ayrıca, yaklaşan atom ve yüzey atomlarının dalga fonksiyonlarının ortogonalliği nedeniyle sistemin enerjisi artacaktır.
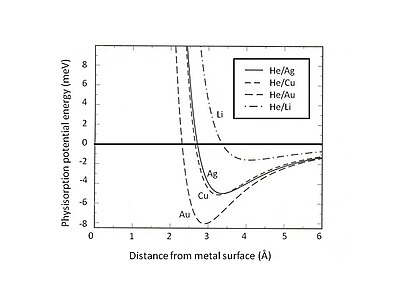
Bu Pauli dışlama ve itme, yüzey etkileşimine hakim olan kapalı değerlik kabukları olan atomlar için özellikle güçlüdür. Sonuç olarak, minimum fizisorpsiyon enerjisi, uzun menzilli van der Waals çekimi ile kısa menzilli Pauli itmesi arasındaki denge ile bulunmalıdır . Örneğin, fizisorpsiyonun toplam etkileşimini iki katkıya ayırarak - Hartree-Fock teorisi ve uzun menzilli van der Waals çekimi tarafından gösterilen kısa menzilli bir terim - jöle substratı üzerinde adsorbe edilen nadir gazlar için fizisorpsiyonun denge konumu belirlenebilir. . Şekil 2, jellium modeli tarafından tanımlanan Ag, Cu ve Au substratları üzerine adsorbe edilen He'nin fizisorpsiyon potansiyel enerjisini gösterir ve farklı yoğunluktaki bulaşma pozitif yükleri vardır. Zayıf van der Waals etkileşiminin sığ çekici enerji kuyularına (<10 meV) yol açtığı bulunabilir. Fizisorpsiyon potansiyel enerjisini keşfetmeye yönelik deneysel yöntemlerden biri, örneğin metal yüzeylerden saçılan soy gaz atomları gibi saçılma işlemidir. Saçılan atomlar ve yüzey arasındaki etkileşim potansiyelinin belirli belirli özellikleri, saçılan parçacıkların deneysel olarak belirlenen açısal dağılımı ve kesitleri analiz edilerek çıkarılabilir.
Quantum Mechanical - Yüzey alanı ve gözeneklilik için termodinamik modelleme
1980'den beri adsorpsiyonu açıklamak ve çalışan denklemleri elde etmek için iki teori üzerinde çalışıldı. Bu ikisi, chi hipotezi, kuantum mekaniksel türev ve Aşırı Yüzey Çalışması, ESW olarak adlandırılır. Bu teorilerin her ikisi de düz yüzeyler için aynı denklemi verir:
Burada U birim adım fonksiyonudur. Diğer sembollerin tanımları aşağıdaki gibidir:
burada "reklamlar", "adsorbe", "m", "tek katmanlı eşdeğerlik" anlamına gelir ve "vap", buhar basıncına atıfta bulunur ("reklamlar" ve "vap", en son IUPAC sözleşmesidir, ancak "m"nin IUAPC eşdeğeri yoktur. katı numune ile aynı sıcaklıkta sıvı adsorpsiyonun gösterimi). Birim işlevi, ilk adsorbe edilen molekül için adsorpsiyonun molar enerjisinin tanımını şu şekilde oluşturur:
Arsa adsorbe karşı chi arsa olarak adlandırılır. Düz yüzeyler için chi grafiğinin eğimi yüzey alanını verir. Ampirik olarak, bu arsa Polanyi ve ayrıca deBoer ve Zwikker tarafından izoterme çok iyi bir uyum olarak fark edildi, ancak takip edilmedi. Bu, ilk durumda Einstein tarafından ve ikinci durumda Brunauer tarafından yapılan eleştirilerden kaynaklanıyordu. Bu düz yüzey denklemi dışında, karşılaştırma eğrileri normal gelenek bir "standart eğrisi" olarak kullanılabilir olduğu grafiğinin gözenekli numunenin ilk kısmı karşı kendiliğinden bir standart olarak görev yapar. Ultramikro gözenekli, mikro gözenekli ve mezo gözenekli koşullar bu teknik kullanılarak analiz edilebilir. Gözenekli numuneler dahil olmak üzere tam izoterm uyumu için tipik standart sapmalar tipik olarak %2'den azdır.
Homojen gözeneksiz bir yüzey üzerindeki iyi verilere tipik bir uyum şekil 3'te gösterilmektedir. Veriler Payne, Sing ve Turk'e aittir ve -s standart eğrisini oluşturmak için kullanılmıştır . Yalnızca 0,05 ila 0,35 P / P vap aralığına en iyi şekilde uyan BET'in aksine, uyum aralığı tam izotermdir .
kemisorpsiyon ile karşılaştırma
- Fiziki adsorpsiyon genel bir olgudur ve herhangi bir katı/sıvı veya katı/gaz sisteminde meydana gelir. Kemisorpsiyon , kimyasal özgüllük ile karakterize edilir.
- Fiziksel adsorpsiyonda, adsorban ve adsorbatların elektronik durumlarının bozulması minimumdur. Adsorpsiyon kuvvetleri arasında Londra Kuvvetleri, dipol-dipol çekimleri, dipol kaynaklı çekim ve "hidrojen bağı" yer alır. Kemisorpsiyon için, elektronik durumlardaki değişiklikler uygun fiziksel yollarla, başka bir deyişle kimyasal bağlanmayla saptanabilir.
- Fiziksel adsorpsiyonun tipik bağlanma enerjisi yaklaşık 10-300 meV'dir ve lokalize değildir. Kemisorpsiyon genellikle 1-10 eV enerji ile bağ oluşturur ve lokalizedir.
- Bir gaz fazından fizisorpsiyondaki temel adım, bir aktivasyon enerjisi içermez. Kemisorpsiyon genellikle bir aktivasyon enerjisini içerir.
- Fiziksel adsorpsiyon için gaz fazı molekülleri, adsorbatlar, gözeneklilik gibi fiziksel engeller müdahale etmedikçe çok katmanlı adsorpsiyon oluşturur. Kemisorpsiyonda, moleküller yüzeyde değerlik bağları ile adsorbe edilir ve sadece tek tabakalı adsorpsiyon oluşturur.
- Bir atomik kuvvet mikroskobunun ucuna bir CO molekülü takılarak ve tek bir demir atomu ile etkileşimi ölçülerek fizisorpsiyondan kemisorpsiyona doğrudan bir geçiş gözlemlenmiştir. Bu etki, 1960'ların sonlarında alan emisyonu ve ESR ölçümlerinden gözlemlendi ve Moyes ve Wells tarafından rapor edildi.



















