Lipit iki tabakalı - Lipid bilayer

Lipit iki tabakalı (ya da çift katlı fosfolipid ) bir ince polar membran iki katmandan oluşur lipit molekülleri . Bu zarlar, tüm hücrelerin etrafında sürekli bir bariyer oluşturan düz levhalardır . Hücre zarları neredeyse tüm organizmalar ve birçok virüs gibidir, bir lipid tabakasının yapılır nükleer membran çevreleyen hücre çekirdeği ve membranlar arasında membrana bağlı organelleri hücrede. Lipid çift tabakası, iyonları , proteinleri ve diğer molekülleri ihtiyaç duyulan yerde tutan ve olmaması gereken yerlere yayılmasını önleyen bariyerdir . Lipid çift katmanları, genişlikleri yalnızca birkaç nanometre olmasına rağmen , suda çözünen ( hidrofilik ) moleküllerin çoğuna karşı geçirimsiz olduklarından bu rol için idealdir . Çift tabakalar özellikle iyonlara karşı geçirimsizdir, bu da hücrelerin iyon pompaları adı verilen proteinleri kullanarak iyonları zarları boyunca taşıyarak tuz konsantrasyonlarını ve pH'ı düzenlemesine izin verir .
Biyolojik çift tabakalar genellikle hidrofilik bir fosfat başı ve iki yağ asidi zincirinden oluşan bir hidrofobik kuyruğa sahip amfifilik fosfolipitlerden oluşur . Belirli baş gruplarına sahip fosfolipidler, bir çift tabakanın yüzey kimyasını değiştirebilir ve örneğin, hücre zarlarındaki diğer moleküller için sinyaller ve ayrıca "çapa" olarak hizmet edebilir. Tıpkı kafalar gibi, lipitlerin kuyrukları da örneğin çift tabakanın fazını belirleyerek membran özelliklerini etkileyebilir . İki tabakalı bir katı benimseyebilir jel düşük sıcaklıklarda faz durumunu fakat tabi faz geçişine a akışkan bir halde , daha yüksek sıcaklıklarda ve lipidlerin kuyrukları kimyasal özellikleri, bu durumda bu sıcaklıkta etkilemektedir. Lipidlerin çift tabaka içinde paketlenmesi, gerilme ve bükülmeye karşı direnci de dahil olmak üzere mekanik özelliklerini de etkiler. Bu özelliklerin çoğu, bir laboratuarda üretilen yapay "model" çift katmanların kullanımıyla incelenmiştir. Model çift katmanlar tarafından yapılan veziküller de klinik olarak ilaç vermek için kullanılmıştır.
Biyolojik membranlar tipik olarak fosfolipidler dışında birkaç tip molekül içerir. Hayvan hücrelerinde özellikle önemli bir örnek , çift tabakayı güçlendirmeye ve geçirgenliğini azaltmaya yardımcı olan kolesteroldür . Kolesterol ayrıca belirli integral membran proteinlerinin aktivitesini düzenlemeye yardımcı olur . İntegral membran proteinleri, bir lipit çift tabakasına dahil edildiklerinde işlev görürler ve halka şeklindeki bir lipit kabuğu yardımıyla lipit çift tabakasına sıkıca tutulurlar . Çift katmanlar hücrenin sınırlarını ve bölmelerini tanımladığından, bu zar proteinleri birçok hücre içi ve hücreler arası sinyalleşme sürecinde yer alır. Belirli türdeki zar proteinleri, iki çift katmanı bir araya getirme sürecinde yer alır. Bu füzyon , bir yumurtanın bir sperm tarafından döllenmesi veya bir virüsün bir hücreye girmesi sırasında akrozom reaksiyonunda olduğu gibi iki farklı yapının birleşmesini sağlar . Lipid çift katmanları kırılgan ve geleneksel bir mikroskopta görünmez olduklarından, incelenmesi zor bir iştir. Çift katmanlar üzerindeki deneyler genellikle elektron mikroskobu ve atomik kuvvet mikroskobu gibi ileri teknikleri gerektirir .
Yapı ve organizasyon
Fosfolipidler suya maruz kaldıklarında , hidrofobik kuyrukları tabakanın merkezine doğru bakacak şekilde iki tabakalı bir tabaka halinde kendiliğinden birleşirler. Bu düzenleme, her biri tek bir moleküler katman olan iki "broşür" ile sonuçlanır. Bu çift tabakanın merkezi neredeyse hiç su içermez ve suda çözünen şekerler veya tuzlar gibi molekülleri hariç tutar . Montaj işlemi, hidrofobik moleküller arasındaki etkileşimler tarafından yönlendirilir ( hidrofobik etki olarak da adlandırılır ). Hidrofobik moleküller arasındaki etkileşimlerdeki artış (hidrofobik bölgelerin kümelenmesine neden olur), su moleküllerinin birbirleriyle daha serbest bir şekilde bağlanmasına izin vererek sistemin entropisini arttırır. Bu karmaşık süreç, van der Waals kuvvetleri , elektrostatik ve hidrojen bağları gibi kovalent olmayan etkileşimleri içerir .
Kesit analizi
Lipid çift tabakası, yan boyutlarına göre çok incedir. Tipik bir memeli hücresi (çap ~10 mikrometre) bir karpuz boyutuna (~1 ft/30 cm) büyütülürse, plazma zarını oluşturan çift lipid tabakası bir ofis kağıdı kadar kalın olacaktır. Sadece birkaç nanometre kalınlığında olmasına rağmen, çift tabaka, enine kesiti boyunca birkaç farklı kimyasal bölgeden oluşur. Bu bölgeler ve çevrelerindeki su ile etkileşimleri, son birkaç on yılda x-ışını reflektometrisi , nötron saçılması ve nükleer manyetik rezonans teknikleri ile karakterize edilmiştir.
Çift tabakanın her iki tarafındaki ilk bölge hidrofilik baş gruptur. Membranın bu kısmı tamamen hidratlıdır ve tipik olarak yaklaşık 0.8-0.9 nm kalınlığındadır. Olarak fosfolipid ikili tabakalar fosfat grubu, bu hidratlı bölgede hidrofobik çekirdeğin dışında yaklaşık olarak 0.5 nm bulunmaktadır. Bazı durumlarda, hidratlı bölge, örneğin başa aşılanmış büyük bir protein veya uzun şeker zincirine sahip lipidlerde, çok daha fazla uzayabilir. Doğada böyle bir değişikliğin yaygın bir örneği, bakterinin dış zarı üzerindeki lipopolisakkarit kaplamadır ve bu, dehidrasyonu önlemek için bakterinin etrafında bir su tabakasının tutulmasına yardımcı olur .

Hidratlı bölgenin yanında sadece kısmen hidratlı bir ara bölge bulunur. Bu sınır tabaka yaklaşık olarak 0,3 nm kalınlığındadır. Bu kısa mesafe içinde, su konsantrasyonu ana grup tarafında 2M'den kuyruk (çekirdek) tarafında neredeyse sıfıra düşer. Çift tabakanın hidrofobik çekirdeği tipik olarak 3-4 nm kalınlığındadır, ancak bu değer zincir uzunluğuna ve kimyaya göre değişir. Çekirdek kalınlığı ayrıca, özellikle bir faz geçişinin yakınında, sıcaklıkla önemli ölçüde değişir.
asimetri
Doğal olarak oluşan birçok çift katmanda, iç ve dış zar yaprakçıklarının bileşimleri farklıdır. İnsan kırmızı kan hücrelerinde , iç (sitoplazmik) yaprakçık çoğunlukla fosfatidiletanolamin , fosfatidilserin ve fosfatidilinositol ve bunun fosforlanmış türevlerinden oluşur. Buna karşılık, dış (hücre dışı) broşür fosfatidilkolin , sfingomyelin ve çeşitli glikolipidlere dayanmaktadır . Bazı durumlarda, bu asimetri, lipitlerin hücrede nerede yapıldığına dayanır ve ilk yönelimlerini yansıtır. Lipid asimetrisinin biyolojik işlevleri, birkaç farklı durumda kullanıldığı açık olmasına rağmen, tam olarak anlaşılamamıştır. Örneğin, bir hücre apoptoza girdiğinde , normalde sitoplazmik yaprakçıkta lokalize olan fosfatidilserin dış yüzeye aktarılır: Orada, ölmekte olan hücreyi aktif olarak temizleyen bir makrofaj tarafından tanınır .
Lipid asimetrisi, en azından kısmen, çoğu fosfolipidin sentezlenmesi ve başlangıçta iç tek tabakaya yerleştirilmesi gerçeğinden kaynaklanır: dış tek tabakayı oluşturanlar daha sonra iç tek tabakadan flippazlar adı verilen bir enzim sınıfı tarafından taşınır . Sfingomyelin gibi diğer lipidlerin dış broşürde sentezlendiği görülmektedir. Flippazlar, lipidleri ters yönde transfer eden floppazlar ve lipid çift katmanları arasında (apoptotik hücrelerde olduğu gibi) lipid dağılımını randomize eden scramblazları da içeren daha büyük bir lipid taşıma molekülleri ailesinin üyeleridir. Her durumda, lipid asimetrisi bir kez sağlandığında, normalde hızlı bir şekilde dağılmaz çünkü broşürler arasında lipidlerin spontane geçişi son derece yavaştır.
Bu asimetriyi laboratuvar ortamında model çift katmanlı sistemlerde taklit etmek mümkündür. Bazı çok küçük yapay kesecik türleri, bu asimetrinin oluşturulduğu mekanizma hücrelerdekinden çok farklı olsa da, kendilerini otomatik olarak biraz asimetrik yapacaktır. Langmuir-Blodgett birikiminde iki farklı tek tabakanın kullanılmasıyla veya Langmuir-Blodgett ve vezikül yırtılması birikiminin bir kombinasyonu kullanılarak asimetrik bir düzlemsel çift tabakanın sentezlenmesi de mümkündür. Bu asimetri, desteklenen çift katmanlardaki lipidler flip-flop'a eğilimli olabileceğinden zamanla kaybolabilir.
Fazlar ve faz geçişleri
Belirli bir sıcaklıkta, bir lipit çift tabakası, bir sıvı veya bir jel (katı) fazda bulunabilir. Tüm lipidler, jelden sıvı faza geçiş yaptıkları (eridikleri) karakteristik bir sıcaklığa sahiptir. Her iki fazda da lipit moleküllerinin çift katman boyunca iki yana kayması engellenir, ancak sıvı faz çift katmanlarında belirli bir lipid, komşusu ile saniyede milyonlarca kez yer değiştirir. Bu rastgele yürüyüş değişimi, lipidin difüze olmasına ve böylece zarın yüzeyinde dolaşmasına izin verir . Sıvı faz çift katmanlarından farklı olarak, jel faz çift katmanındaki lipidler daha az hareketliliğe sahiptir.
Lipid çift katmanlarının faz davranışı, büyük ölçüde, bitişik lipid molekülleri arasındaki çekici Van der Waals etkileşimlerinin gücü ile belirlenir . Daha uzun kuyruklu lipitler, etkileşim için daha fazla alana sahiptir, bu etkileşimin gücünü arttırır ve sonuç olarak lipit hareketliliğini azaltır. Bu nedenle, belirli bir sıcaklıkta, kısa kuyruklu bir lipit, aksi takdirde özdeş bir uzun kuyruklu lipitten daha akışkan olacaktır. Geçiş sıcaklığı , lipid kuyruklarının doymamışlık derecesinden de etkilenebilir . Doymamış bir çift bağ , alkan zincirinde lipid paketlemesini bozan bir bükülme üretebilir . Bu bozulma, çift katman içinde bitişik zincirlerde ek esneklik sağlayan ekstra boş alan yaratır. Bu etkinin bir örneği, günlük hayatta büyük oranda doymuş yağ içeren tereyağı oda sıcaklığında katı iken, çoğunlukla doymamış olan bitkisel yağın sıvı olması olarak not edilebilir.
Çoğu doğal zar, farklı lipid moleküllerinin karmaşık bir karışımıdır. Bileşenlerden bazıları belirli bir sıcaklıkta sıvıyken diğerleri jel fazındaysa, iki faz, okyanusta yüzen bir buzdağı gibi, uzaysal olarak ayrılmış bölgelerde bir arada bulunabilir. Bu faz ayrımı biyokimyasal olaylarda kritik bir rol oynar, çünkü proteinler gibi zar bileşenleri bir veya diğer faza bölünebilir ve böylece lokal olarak konsantre edilebilir veya aktive edilebilir. Birçok karışık faz sisteminin özellikle önemli bir bileşeni, iki tabakalı geçirgenliği, mekanik gücü ve biyokimyasal etkileşimleri modüle eden kolesteroldür .
yüzey kimyası
Lipid kuyrukları esas olarak iki tabakalı faz davranışını modüle ederken, iki tabakalı yüzey kimyasını belirleyen ana gruptur. Doğal çift katmanların çoğu esas olarak fosfolipidlerden oluşur , ancak sfingolipidler ve kolesterol gibi steroller de önemli bileşenlerdir. Fosfolipidlerin en yaygın baş grubu, çoğu memeli hücresindeki fosfolipidlerin yaklaşık yarısını oluşturan fosfatidilkolindir (PC). PC, fosfat grubu üzerinde negatif bir yüke ve amin üzerinde bir pozitif yüke sahip olduğu için zwitteriyonik bir baş gruptur, ancak bu yerel yükler dengelendiğinden net yük yoktur.
Diğer ana gruplar da değişen derecelerde mevcuttur ve fosfatidilserin (PS) fosfatidiletanolamin (PE) ve fosfatidilgliserol (PG) içerebilir . Bu alternatif ana gruplar genellikle, yüksek düzeyde bağlama bağlı olan spesifik biyolojik işlevsellik sağlar. Örneğin, eritrositlerin hücre dışı membran yüzündeki PS varlığı, hücre apoptozunun bir belirtecidir , oysa büyüme plakası veziküllerindeki PS , hidroksiapatit kristallerinin çekirdeklenmesi ve ardından kemik mineralizasyonu için gereklidir . PC'den farklı olarak, diğer ana grupların bazıları, küçük moleküllerin çift katman ile elektrostatik etkileşimlerini değiştirebilen net bir yük taşır.
biyolojik roller
Muhafaza ve ayırma
Biyolojide lipid çift tabakasının birincil rolü, sulu bölmeleri çevrelerinden ayırmaktır . “Ben”i “öz-olmayan”dan ayıran bir tür bariyer olmadan, bir organizma ya da yaşam kavramını tanımlamak bile zordur. Bu bariyer, özel olarak uyarlanmış bir lipid tek tabakasını kullanan birkaç arke türü dışında, bilinen tüm yaşam formlarında bir lipit çift tabakası şeklini alır . Hatta yaşamın ilk formunun, neredeyse tek biyosentetik yeteneğinin daha fazla fosfolipit üretimi olan basit bir lipid keseciği olabileceği bile öne sürülmüştür . Lipid çift katmanının bölümleme yeteneği, aşağıdaki çift katman boyunca Transport bölümünde tartışıldığı gibi , hidrofilik moleküllerin hidrofobik çift katmanlı çekirdeği kolayca geçememesi gerçeğine dayanır . Çekirdek, mitokondri ve kloroplastlar iki lipid çift katmanına sahipken, diğer alt hücre yapıları tek bir lipid çift katmanı (plazma zarı, endoplazmik retikül, Golgi aygıtı ve lizozomlar gibi) ile çevrilidir. Bakınız Organel .
Prokaryotların tek bir lipid çift tabakası vardır - hücre zarı (plazma zarı olarak da bilinir). Birçok prokaryotta ayrıca bir hücre duvarı vardır , ancak hücre duvarı lipitlerden değil proteinlerden veya uzun zincirli karbonhidratlardan oluşur . Buna karşılık, ökaryotlar çekirdek , mitokondri , lizozomlar ve endoplazmik retikulum dahil olmak üzere bir dizi organele sahiptir . Bu hücre altı bölümlerin tümü, bir veya daha fazla lipid çift tabakası ile çevrilidir ve birlikte tipik olarak hücrede bulunan çift tabakalı alanın çoğunluğunu oluşturur. Örneğin karaciğer hepatositlerinde , plazma zarı hücrenin toplam çift katmanlı alanının sadece yüzde ikisini oluştururken, endoplazmik retikulum yüzde elliden fazlasını ve mitokondri yüzde otuzunu daha içerir.

sinyalizasyon
Muhtemelen hücresel sinyal en çok bilinen biçimi , sinaptik transmisyon bir sonuna ulaştığı bir sinir itişi sayede, nöron salınımı aracılığıyla bitişik bir nöron nakledilir nörotransmitter . Bu iletim, salınacak nörotransmitterlerle yüklü sinaptik veziküllerin hareketi ile mümkün olur. Bu veziküller sigorta presinaptik terminalinde hücre zarı ile hücrenin dış içeriğini serbest bırakın. İçerik daha sonra sinaps boyunca sinaptik sonrası terminale yayılır.
Lipid çift katmanları ayrıca, integral membran proteinlerinin evi olarak rolleri yoluyla sinyal iletiminde yer alır . Bu, son derece geniş ve önemli bir biyomolekül sınıfıdır. İnsan proteomunun üçte birinin zar proteinleri olduğu tahmin edilmektedir . Bu proteinlerin bazıları hücre zarının dışına bağlıdır. Buna bir örnek, hücreleri "kendi" olarak tanımlayan ve böylece bağışıklık sistemi tarafından yok edilmelerini engelleyen CD59 proteinidir. HIV virüsü kurtulan bağışıklık sistemini kendi yüzeyi üzerine konakçı membrandan bu proteinleri aşılanmasıyla parçası. Alternatif olarak, bazı zar proteinleri çift tabakanın tamamına nüfuz eder ve bireysel sinyal olaylarını hücrenin dışından içine iletmeye hizmet eder. Bu tip proteinin en yaygın sınıfı, G proteinine bağlı reseptördür (GPCR). GPCR'ler, hücrenin çevresini algılama yeteneğinin çoğundan sorumludur ve bu önemli rol nedeniyle, tüm modern ilaçların yaklaşık %40'ı GPCR'leri hedef alır.
Protein ve çözelti aracılı işlemlere ek olarak, lipit çift katmanlarının doğrudan sinyalleşmeye katılması da mümkündür. Bunun klasik bir örneği fosfatidilserin ile tetiklenen fagositozdur . Normalde, fosfatidilserin hücre zarında asimetrik olarak dağılır ve sadece iç tarafta bulunur. Programlanmış hücre ölümü sırasında, scramblase adı verilen bir protein , hücre dışı çift katmanlı yüzünde fosfatidilserin göstererek bu dağılımı dengeler. Fosfatidilserin varlığı daha sonra ölü veya ölmekte olan hücreyi çıkarmak için fagositozu tetikler.
Karakterizasyon yöntemleri

Lipid çift tabakası çok ince ve kırılgan olduğu için incelenmesi çok zor bir yapıdır. Bu sınırlamalara rağmen, son yetmiş yılda, yapısının ve işlevinin araştırılmasına izin vermek için düzinelerce teknik geliştirilmiştir.
Elektriksel ölçümler
Elektriksel ölçümler, bir çift katmanın önemli bir işlevini karakterize etmenin basit bir yoludur: çözeltideki iyonların akışını ayırma ve engelleme yeteneği. Çift tabakaya bir voltaj uygulayarak ve ortaya çıkan akımı ölçerek çift tabakanın direnci belirlenir. Bu direnç, genellikle oldukça yüksektir (10 8 ohm-cm 2 ya da daha fazla), hidrofobik çekirdek yüklü türler geçirmeyen olduğu. Birkaç nanometre ölçekli deliklerin varlığı bile akımda çarpıcı bir artışa neden olur. Bu sistemin hassasiyeti, tek iyon kanallarının aktivitesi bile çözülebilecek şekildedir.
Floresan mikroskobu

Elektriksel ölçümler, mikroskop kutusuyla görüntüleme gibi gerçek bir resim sağlamaz. Lipid çift katmanları, çok ince oldukları için geleneksel bir mikroskopta görülemez. Çift katmanları görmek için araştırmacılar genellikle floresan mikroskobu kullanırlar . Bir numune, bir ışık dalga boyu ile uyarılır ve farklı bir dalga boyunda gözlenir, böylece sadece eşleşen bir uyarma ve emisyon profiline sahip floresan moleküller görülecektir. Doğal lipid çift katmanları floresan değildir, bu nedenle çift katmanda istenen moleküllere bağlanan bir boya kullanılır. Çözünürlük genellikle birkaç yüz nanometre ile sınırlıdır, tipik bir hücreden çok daha küçüktür, ancak bir lipid çift tabakasının kalınlığından çok daha büyüktür.
Elektron mikroskobu
Elektron mikroskobu daha yüksek çözünürlüklü bir görüntü sunar. Bir elektron mikroskobunda , odaklanmış elektron demeti, geleneksel mikroskopta olduğu gibi bir ışık demeti yerine numune ile etkileşime girer. Hızlı dondurma teknikleri ile bağlantılı olarak, elektron mikroskopisi de gösteren, örneğin arası ve hücre içi ulaşım mekanizmalarını incelemek için kullanılmıştır eksositotik veziküller kimyasal ayrışma araçları olan sinapsların .
Nükleer manyetik rezonans Spektroskopisi
31 P- NMR(nükleer manyetik rezonans) spektroskopisi , doğal koşullarda fosfolipid çift katmanları ve biyolojik membranların çalışmaları için yaygın olarak kullanılmaktadır. 31 P-NMR lipit spektrumunun analizi, lipit çift katmanlı paketleme, faz geçişleri (jel fazı, fizyolojik sıvı kristal faz, dalgalanma fazlar, iki katmanlı olmayan fazlar), lipit baş grubu oryantasyonu/dinamiği ve elastik hakkında geniş bir bilgi yelpazesi sağlayabilir. saf lipid çift tabakasının özellikleri ve proteinlerin ve diğer biyomoleküllerin bağlanmasının bir sonucu olarak.
Atomik kuvvet mikroskopisi


Lipid çift katmanlarını incelemek için yeni bir yöntem Atomik kuvvet mikroskobudur (AFM). Bir ışık demeti veya parçacık kullanmak yerine, çok küçük keskinleştirilmiş bir uç, çift katmanla fiziksel temas kurarak ve bir plak çalar iğnesi gibi üzerinde hareket ederek yüzeyi tarar. AFM umut verici bir tekniktir çünkü oda sıcaklığında ve hatta su veya fizyolojik tampon altında, doğal çift katmanlı davranış için gerekli koşullar altında nanometre çözünürlükte görüntü alma potansiyeline sahiptir. Bu yeteneği kullanarak, AFM, transmembran gözeneklerin (delikler) oluşumu ve desteklenen çift katmanlarda faz geçişleri dahil olmak üzere dinamik çift katmanlı davranışı incelemek için kullanılmıştır. Diğer bir avantaj, prob ucu çift katmanlı yüzey ile mekanik olarak etkileşime girdiğinden, AFM'nin lipidlerin floresan veya izotopik etiketlemesini gerektirmemesidir . Bu nedenle, aynı tarama hem lipidleri hem de ilişkili proteinleri, bazen tek molekül çözünürlüğünde bile görüntüleyebilir. AFM ayrıca lipit çift katmanlarının mekanik yapısını da araştırabilir.
Çift polarizasyon interferometrisi
Lipid çift katmanları, çift katmanın düzlemindeki kırılma indisinin, dikey olandan 0.1 kırılma indisi birimi kadar farklı olduğu durumlarda, yüksek düzeyde çift kırılma sergiler . Bu, protein etkileşim mekanizmalarını anlamak için çift polarizasyon interferometrisi kullanarak çift katmanlardaki düzen ve bozulma derecesini karakterize etmek için kullanılmıştır .
Kuantum kimyasal hesaplamaları
Lipid çift katmanları, birçok serbestlik derecesine sahip karmaşık moleküler sistemlerdir. Bu nedenle, zarın atomistik simülasyonu ve özellikle özelliklerinin ab initio hesaplamaları zordur ve hesaplama açısından pahalıdır. Kuantum kimyasal hesaplamaları, lipid membranların dipol ve dört kutuplu momentlerini tahmin etmek için son zamanlarda başarıyla gerçekleştirilmiştir .
Çift katman boyunca taşıma
Pasif difüzyon
Çoğu polar molekül , bir lipid çift tabakasının hidrokarbon çekirdeğinde düşük çözünürlüğe sahiptir ve sonuç olarak, çift tabaka boyunca düşük geçirgenlik katsayılarına sahiptir. Bu etki, özellikle nötr polar moleküllerden daha düşük geçirgenlik katsayılarına sahip olan yüklü türler için belirgindir. Anyonlar, tipik olarak, katyonlardan daha çift katmanlar arasında daha yüksek bir difüzyon hızına sahiptir . İyonlarla karşılaştırıldığında, su molekülleri, ozmotik şişme ile kanıtlandığı gibi, aslında çift katman boyunca nispeten büyük bir geçirgenliğe sahiptir . Yüksek iç tuz konsantrasyonuna sahip bir hücre veya kesecik, düşük tuz konsantrasyonuna sahip bir çözeltiye yerleştirildiğinde şişer ve sonunda patlar. Böyle bir sonuç, su çift tabakadan nispi kolaylıkla geçmedikçe gözlemlenmeyecektir. Suyun çift katmanlardan anormal derecede büyük geçirgenliği hala tam olarak anlaşılmamıştır ve aktif tartışma konusu olmaya devam etmektedir. Küçük yüksüz apolar moleküller, lipit çift katmanları boyunca iyonlardan veya sudan çok daha hızlı yayılır. Bu, hem yağlar hem de kloroform ve eter gibi organik çözücüler için geçerlidir . Polar karakterlerinden bağımsız olarak daha büyük moleküller, lipid çift katmanları arasında küçük moleküllerden daha yavaş yayılır.

İyon pompaları ve kanalları
İki özel protein sınıfı, doğal iyon kanalları ve iyon pompalarında hücresel ve hücre altı membranlarda bulunan iyonik gradyanlarla ilgilenir . Hem pompalar hem de kanallar , çift tabakadan geçen bütünleyici zar proteinleridir , ancak rolleri oldukça farklıdır. İyon pompaları, iyonları konsantrasyon gradyanına karşı daha yüksek kimyasal potansiyele sahip bir alana taşımak için harici bir enerji kaynağı kullanarak kimyasal gradyanları oluşturan ve koruyan proteinlerdir . Enerji kaynağı , Na + -K + ATPase'de olduğu gibi ATP olabilir . Alternatif olarak, enerji kaynağı, Ca2 + /Na + antiporter'de olduğu gibi, halihazırda mevcut olan başka bir kimyasal gradyan olabilir . Hücrelerin , proton pompalama yoluyla pH'ı düzenleyebilmeleri iyon pompalarının etkisi ile gerçekleşir .
İyon pompalarının aksine, iyon kanalları kimyasal gradyanlar oluşturmaz, daha ziyade iş yapmak veya bir sinyal göndermek için bunları dağıtır. Muhtemelen en tanıdık ve en iyi çalışılmış örnek, nöronlar boyunca bir aksiyon potansiyelinin iletilmesine izin veren voltaj kapılı Na + kanalıdır . Tüm iyon pompalarında bir çeşit tetikleme veya "geçitleme" mekanizması bulunur. Önceki örnekte bu elektrik önyargısıydı, ancak diğer kanallar bir moleküler agonist bağlanarak veya yakındaki başka bir proteinde konformasyonel bir değişiklik yoluyla aktive edilebilir.
Endositoz ve ekzositoz
Bazı moleküller veya parçacıklar, bir lipid çift tabakasından geçemeyecek kadar büyük veya hidrofiliktir. Diğer moleküller çift tabakadan geçebilir, ancak o kadar büyük sayılarda hızlı bir şekilde taşınmaları gerekir ki, kanal tipi taşıma pratik değildir. Her iki durumda da, bu tür kargolar veziküllerin füzyonu veya tomurcuklanması yoluyla hücre zarı boyunca hareket ettirilebilir . Hücre içinde bir kesecik üretildiğinde ve içeriğini hücre dışı boşluğa bırakmak için plazma zarı ile birleştiğinde, bu süreç ekzositoz olarak bilinir. Tersine işlemde, hücre zarının bir bölgesi içe doğru çukurlaşacak ve sonunda hücre dışı sıvının bir kısmını hücreye taşımak için çevreleyerek sıkışacaktır. Endositoz ve ekzositoz, işlev görmek için çok farklı moleküler makinelere ihtiyaç duyar, ancak iki süreç yakından bağlantılıdır ve birbirleri olmadan çalışamazlar. Bu karşılıklı bağımlılığın birincil mekanizması, dahil olan büyük miktarda lipit materyalidir. Tipik bir hücrede, tüm plazma zarına eşdeğer bir çift katmanlı alan, yaklaşık yarım saat içinde endositoz/ekzositoz döngüsünden geçecektir. Bu iki süreç birbirini dengelemiyorsa, hücre ya dışa doğru yönetilemez bir boyuta balonla çıkacak ya da kısa sürede plazma zarını tamamen tüketecektir.
Prokaryotlarda ekzositoz : Halk arasında membran vezikül kaçakçılığı olarak bilinen , Nobel ödüllü (yıl, 2013) bir süreç olan membran veziküler ekzositoz , geleneksel olarak ökaryotik hücrelerin ayrıcalığı olarak kabul edilir . Bu mit Ancak nanovesicles, halk olarak bilinen bu açığa ile kırılmış bakteriyel dış membran veziküllerinin , tarafından yayınlanan gram-negatif olarak, mikroplar, salgılayan mikrop örneğin lehine birden çok işlem gerçekleştirmek için konakçı veya hedef hücrelere bakteriyel sinyal molekülleri transloke ev sahibi genel olarak hücre istilası ve mikrop-çevre etkileşimleri.
elektroporasyon
Elektroporasyon, membran boyunca büyük bir yapay elektrik alanının uygulanmasıyla indüklenen çift katmanlı geçirgenlikteki hızlı artıştır. Deneysel olarak, hidrofilik molekülleri hücrelere sokmak için elektroporasyon kullanılır. Hidrofobik çift katmanlı çekirdek boyunca asla pasif olarak yayılmayacak olan DNA gibi yüksek yüklü moleküller için özellikle yararlı bir tekniktir . Bu nedenle elektroporasyon, bakteriyel transformasyonun yanı sıra transfeksiyonun anahtar yöntemlerinden biridir . Yıldırım çarpmalarından kaynaklanan elektroporasyonun doğal bir yatay gen aktarımı mekanizması olabileceği bile öne sürülmüştür .
Geçirgenlikteki bu artış, esas olarak iyonların ve diğer hidratlı türlerin taşınmasını etkiler, bu da mekanizmanın zarda nm ölçeğinde su dolu deliklerin oluşturulması olduğunu gösterir. Elektroporasyon ve dielektrik bozulma her ikisi de bir elektrik alanının uygulanmasından kaynaklansa da, ilgili mekanizmalar temelde farklıdır. Dielektrik bozulmada bariyer malzemesi iyonize olur ve iletken bir yol oluşturur. Malzeme değişikliği bu nedenle doğada kimyasaldır. Tersine, elektroporasyon sırasında lipit molekülleri kimyasal olarak değişmezler, sadece konum değiştirirler, su ile dolduğunda çift tabaka boyunca iletken yol görevi gören bir gözenek açarlar.
mekanik
Lipid çift katmanları, sıvıların veya katıların bazı mekanik özelliklerine sahip olacak kadar büyük yapılardır. Alanı, sıkıştırma modülü K bir , modül K bükme b ve kenar enerjinin , bunları tarif etmek için kullanılabilir. Katı lipid çift katmanları da bir kesme modülüne sahiptir , ancak herhangi bir sıvı gibi, sıvı çift katmanları için kesme modülü sıfırdır. Bu mekanik özellikler, zarın nasıl çalıştığını etkiler. K , bir K B çift katman içine eklemek için proteinler ve küçük moleküller yeteneğini etkileyebilir ve mekanik özellikleri, iki tabakalı mekanik aktif iyon kanallarının fonksiyonunu değiştirme gösterilmiştir. İki katmanlı mekanik özellikler, bir hücrenin yırtılmadan ne tür streslere dayanabileceğini de belirler. Lipid çift katmanları kolayca bükülebilse de, çoğu yırtılmadan önce yüzde birkaçtan fazla esneyemez.
Yapı ve organizasyon bölümünde tartışıldığı gibi, lipid kuyruklarının sudaki hidrofobik çekimi, lipid çift katmanlarını bir arada tutan birincil kuvvettir. Bu nedenle, çift tabakanın elastik modülü öncelikle lipid molekülleri birbirinden gerildiğinde ne kadar fazla alanın suya maruz kaldığıyla belirlenir. Çalışmaların, Ka'nın ozmotik basınçla güçlü bir şekilde değiştiğini ancak kuyruk uzunluğu ve doymamışlık ile yalnızca zayıf bir şekilde değiştiğini göstermesi , ilgili kuvvetlere ilişkin bu anlayış göz önüne alındığında şaşırtıcı değildir . Katılan kuvvetler çok küçük olduğundan, deneysel K belirlemek zordur a . Çoğu teknik, gelişmiş mikroskopi ve çok hassas ölçüm ekipmanı gerektirir.
K aksine bir çift katman germek için gerekli olan ne kadar enerji bir ölçüsüdür, K b bükmeyin veya bilayeri flex gereken ne kadar enerji bir ölçüsüdür. Biçimsel olarak bükülme modülü, bir zarı kendi iç eğriliğinden başka bir eğriliğe deforme etmek için gereken enerji olarak tanımlanır. İç eğrilik, kafa grubunun çapının kuyruk grubuna oranı ile tanımlanır. İki kuyruklu PC lipidleri için bu oran neredeyse birdir, dolayısıyla içsel eğrilik neredeyse sıfırdır. Belirli bir lipit sıfır içsel eğrilikten çok büyük bir sapmaya sahipse, bir çift tabaka oluşturmayacak ve bunun yerine miseller veya ters çevrilmiş miseller gibi başka fazlar oluşturacaktır . Eklenmesi küçük hidrofilik moleküller gibi sükroz karma lipid içine katmanlı lipozomlar galaktolipid zengin tilakoid zarlarından yapılan içine iki katmanlı destabilize misel faz. Tipik olarak, K B K ölçümlerinden hesaplanır yerine deneysel olarak ölçülmüş değil, bir üç parametre ile ilgili olduğundan ve iki tabakalı kalınlığa sahiptir.
iki tabakayı yırtarak veya içinde bir delik oluşturarak iki tabakalı bir kenarı suya maruz bırakmak için ne kadar enerji gerektiğinin bir ölçüsüdür. Bu enerjinin kaynağı, böyle bir arayüz oluşturmanın lipid kuyruklarının bir kısmını suya maruz bırakmasıdır, ancak bu sınır lipidlerinin tam oryantasyonu bilinmemektedir. Hem hidrofobik (düz kuyruklar) hem de hidrofilik (kafalar kavisli) gözeneklerin bir arada bulunabileceğine dair bazı kanıtlar vardır.
Füzyon
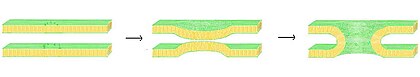
Füzyon , iki lipid çift tabakasının birleştiği ve tek bir bağlantılı yapı ile sonuçlanan süreçtir. Bu füzyon, her iki katmanın her iki broşüründen tamamen geçerse, su dolu bir köprü oluşur ve çift katmanların içerdiği çözeltiler karışabilir. Alternatif olarak, füzyon işleminde her iki katmandan yalnızca bir broşür yer alıyorsa, çift katmanların yarı kaynaşmış olduğu söylenir. Füzyon, ökaryotik hücre geniş ölçüde lipid çift katmanlı zarlar tarafından alt bölümlere ayrıldığından, özellikle ökaryotlarda olmak üzere birçok hücresel süreçte yer alır . Ekzositoz , döllenme , bir bir yumurta ile sperm aktivasyonu ve atık ürünlerin taşıma lysozome füzyonu bir çeşit dayanan birçok ökaryotik süreçlerin birkaçıdır. Birçok çift katmanlı kaplı virüs , konakçı hücreye giriş kazanmak için özel füzyon proteinlerine sahip olduğundan, patojenlerin girişi bile füzyon tarafından yönetilebilir .
Füzyon sürecinde dört temel adım vardır. İlk olarak, ilgili membranlar birbirine birkaç nanometre içinde yaklaşarak toplanmalıdır. İkincisi, iki çift katman çok yakın temas halinde olmalıdır (birkaç angstrom içinde). Bu yakın teması sağlamak için, normalde mevcut olan bağlı yüzey suyu çift tabakaların kuvvetli bir şekilde itilmesine neden olduğundan, iki yüzeyin en azından kısmen susuz kalması gerekir. İyonların varlığı, özellikle magnezyum ve kalsiyum gibi iki değerlikli katyonlar bu adımı güçlü bir şekilde etkiler. Kalsiyumun vücuttaki kritik rollerinden biri membran füzyonunu düzenlemektir. Üçüncüsü, iki çift katman arasında bir noktada yapılarını yerel olarak bozan bir istikrarsızlaştırma oluşmalıdır. Bu bozulmanın kesin doğası bilinmemektedir. Bir teori, iki çift katman arasında oldukça kavisli bir "sap" oluşması gerektiğidir. Bu teorinin savunucuları, oldukça kavisli bir lipid olan fosfatidiletanolamin'in neden füzyonu desteklediğini açıkladığına inanıyor. Son olarak, füzyonun son adımında, bu nokta kusuru büyür ve iki çift tabakanın bileşenleri karışır ve temas bölgesinden uzaklaşır.
Biyolojik füzyon hemen hemen her zaman zarla ilişkili proteinlerin etkisiyle düzenlendiğinden, in vivo füzyon düşünüldüğünde durum daha da karmaşıktır . İncelenecek bu proteinlerin ilki, zarflı bir virüsün genetik materyalini konakçı hücreye yerleştirmesine izin veren viral füzyon proteinleriydi (zarflı virüsler, bir lipid çift tabakası ile çevrili olanlardır; bazılarının sadece bir protein kaplaması vardır). Ökaryotik hücreler ayrıca, en iyi çalışılanları SNARE'ler olan füzyon proteinlerini de kullanırlar . SNARE proteinleri, tüm veziküler hücre içi trafiği yönlendirmek için kullanılır . Yıllarca süren çalışmalara rağmen, bu protein sınıfının işlevi hakkında hala pek çok şey bilinmiyor. Aslında, SNARE'lerin erken yerleştirme ile bağlantılı olup olmadığı veya hemifüzyonu kolaylaştırarak füzyon sürecine daha sonra katılıp katılmadığı konusunda hala aktif bir tartışma var.
Moleküler ve hücresel biyoloji çalışmalarında, füzyonun yapay olarak indüklenmesi genellikle arzu edilir. Polietilen glikol (PEG) ilavesi, önemli agregasyon veya biyokimyasal bozulma olmaksızın füzyona neden olur. Bu prosedür, hemen kaynaştırılması, örneğin yaygın olarak kullanılan B hücreleri ile miyeloma hücreleri. Bu kombinasyondan elde edilen " hibridom ", ilgili B-hücresi tarafından belirlendiği gibi istenen bir antikoru ifade eder , ancak melanom bileşeni nedeniyle ölümsüzleştirilir. Füzyon, elektrofüzyon olarak bilinen bir işlemde elektroporasyon yoluyla yapay olarak da indüklenebilir . Bu fenomenin , elektroporasyon sırasında oluşan enerjik olarak aktif kenarlardan kaynaklandığına inanılmaktadır; bu kenarlar , iki çift katman arasında sap büyümesini çekirdeklendirmek için yerel kusur noktası olarak hareket edebilir.
Model sistemleri
Araştırmacıların doğal çift katmanlarla yapılamayacak deneyler yapmasına izin vermek için laboratuvarda yapay olarak lipit çift katmanları oluşturulabilir. Yapay hücrelerin sınırlarını belirlemek için Sentetik Biyoloji alanında da kullanılabilirler . Bu sentetik sistemlere model lipid çift katmanları denir. Her biri deneysel avantajlara ve dezavantajlara sahip olan birçok farklı model çift katmanı vardır. Sentetik veya doğal lipidlerle yapılabilirler. En yaygın model sistemleri arasında şunlar bulunur:
- Siyah lipid membranlar (BLM)
- Desteklenen lipid çift katmanları (SLB)
- Bağlı Çift Katmanlı Lipid Zarlar (t-BLM)
- veziküller
- Damlacık Arayüz Çift Katmanları (DIB'ler)
Ticari uygulamalar
Bugüne kadar, lipit çift katmanlarının en başarılı ticari uygulaması , özellikle kanser tedavisi için ilaç dağıtımı için lipozomların kullanımı olmuştur . (Not - "lipozom" terimi , vezikülün yapı için genel bir terim olması dışında, özünde " vezikül " ile eşanlamlıdır, ancak lipozom sadece doğal olmayan veziküllere atıfta bulunur) Lipozomal ilaç dağıtımının temel fikri, ilacın kapsüllenmiş olmasıdır. Lipozom içindeki solüsyon daha sonra hastaya enjekte edilir. Bu ilaç yüklü lipozomlar, hedef bölgeye bağlanana ve parçalanana ve ilacı serbest bırakana kadar sistem boyunca hareket eder. Teoride, lipozomlar, hemen hemen her hidrofilik ilacı izole edebildiklerinden, belirli dokuları hedeflemek için moleküllerle aşılanabildiklerinden ve vücut lipidleri parçalamak için biyokimyasal yollara sahip olduğundan nispeten toksik olmadığından ideal bir ilaç dağıtım sistemi yapmalıdır .
İlk nesil ilaç dağıtım lipozomları, basit bir lipid bileşimine sahipti ve çeşitli sınırlamalardan muzdaripti. Hem böbreklerin temizlenmesi hem de fagositoz nedeniyle kan dolaşımındaki dolaşım son derece sınırlıydı . Akışkanlığı, yüzey yük yoğunluğunu ve yüzey hidrasyonunu ayarlamak için lipid bileşiminin iyileştirilmesi, serumdan daha az protein adsorbe eden ve dolayısıyla bağışıklık sistemi tarafından daha az kolay tanınan veziküllerle sonuçlandı . Bu alandaki en önemli ilerleme, bağışıklık veya böbrek temizliği olmadan uzun süre dolaşan “gizli” veziküller üretmek için lipozom yüzeyine polietilen glikolün (PEG) aşılanmasıydı .
İlk gizli lipozomlar pasif olarak tümör dokularını hedef aldı . Tümörler hızlı ve kontrolsüz anjiyogenezi indükledikleri için özellikle "sızdırırlar" ve lipozomların kan dolaşımından normal dokudan çok daha yüksek bir oranda çıkmasına izin verirler. Daha yakın zamanlarda, antikorları veya diğer moleküler belirteçleri, spesifik bir hücre veya doku tipine aktif olarak bağlama umuduyla lipozom yüzeyine aşılamak için çalışmalar yapılmıştır . Bu yaklaşımın bazı örnekleri halihazırda klinik deneylerde bulunmaktadır.
Lipid çift katmanlarının bir başka potansiyel uygulaması, biyosensörler alanıdır . Lipid çift tabakası hücrenin içi ve dışı arasındaki bariyer olduğundan, aynı zamanda geniş sinyal iletiminin yeridir. Yıllar boyunca araştırmacılar, klinik teşhis veya biyoterörizm tespiti için iki katmanlı bir cihaz geliştirmek için bu potansiyelden yararlanmaya çalıştılar. Bu alanda ilerleme yavaş olmuştur ve birkaç şirket otomatik lipid bazlı tespit sistemleri geliştirmiş olsa da, hala araştırma topluluğunu hedef almaktadır. Bunlar arasında, bağlanma kinetiği çalışmalarında lipid çift katmanlarını kullanmak için tek kullanımlık bir çip sunan Biacore (şimdi GE Healthcare Life Sciences) ve otomatik bir yama sıkıştırma sistemi geliştiren Nanion Inc. bulunmaktadır . Oxford Nanolabs tarafından DNA dizilimi için lipid çift katmanlı membran gözeneklerinin kullanımı gibi diğer, daha egzotik uygulamalar da takip edilmektedir. Bugüne kadar, bu teknolojinin ticari olarak uygulanabilirliği kanıtlanmamıştır.
Yukarıda tarif edildiği gibi desteklenen bir lipid çift tabakası (SLB), ilaçların geçirgenliğini ölçmek için bir tarama tekniği olarak ticari başarı elde etmiştir. Bu p arallel bir rtificial m zarı böylesine s ermeability bir ssay PAMPA özel olarak formüle lipit kokteyli (s) boyunca geçirgenliği bulunan teknik tedbirler yüksek ilişkili olduğu , Caco-2 kültürler, gastrointestinal sistem , kan-beyin bariyeri ve cilt.
Tarih
Yirminci yüzyılın başlarında bilim adamları, hücrelerin ince, yağ benzeri bir bariyerle çevrili olduğuna inanmaya başlamışlardı, ancak bu zarın yapısal doğası bilinmiyordu. 1925'teki iki deney, bu boşluğu doldurmak için zemin hazırladı. Hugo Fricke , eritrosit çözeltilerinin kapasitansını ölçerek hücre zarının 3,3 nm kalınlığında olduğunu belirledi.
Bu deneyin sonuçları doğru olmasına rağmen, Fricke verileri hücre zarının tek bir moleküler katman olduğu anlamına gelecek şekilde yanlış yorumladı. Leiden Üniversitesi'nden Prof. Dr. Evert Gorter (1881–1954) ve F. Grendel, soruna farklı bir perspektiften yaklaşarak eritrosit lipidlerini bir Langmuir-Blodgett oluğu üzerinde tek tabaka halinde yayarlar . Tek tabakanın alanını hücrelerin yüzey alanıyla karşılaştırdıklarında, ikiye bir oran buldular. Daha sonraki analizler, bu deneyle ilgili birkaç hata ve yanlış varsayımlar gösterdi, ancak tesadüfen, bu hatalar iptal edildi ve bu kusurlu verilerden Gorter ve Grendel doğru sonucu çıkardı: hücre zarının bir lipid çift tabakası olduğu.
Bu teori, 1950'lerin sonlarında elektron mikroskobunun kullanılmasıyla doğrulandı . J. David Robertson, lipid çift katmanlarının ilk elektron mikroskobu çalışmasını yayınlamamış olsa da, iki koyu elektron yoğun bandın, birbirine bağlı iki lipid tek katmanının ana grupları ve ilişkili proteinleri olduğunu iddia eden ilk kişiydi. Robertson, bu çalışmasında “birim membran” kavramını ortaya koydu. Bu, iki katmanlı yapının evrensel olarak organel zarlarının yanı sıra tüm hücre zarlarına atandığı ilk seferdi .
Aynı zamanda, model membranların geliştirilmesi, lipid çift tabakasının proteinlerden bağımsız olarak var olabilen kararlı bir yapı olduğunu doğruladı. Mueller ve Rudin, bir açıklık boyunca organik çözücü içinde bir lipid çözeltisini "boyayarak" yapay bir çift katman oluşturabildiler ve bunun yanal akışkanlık, yüksek elektrik direnci ve delinmeye tepki olarak kendi kendini iyileştirme özelliği gösterdiğini belirlediler. doğal hücre zarından. Birkaç yıl sonra Alec Bangham , lipid vezikülleri şeklindeki çift tabakaların, sadece kurutulmuş bir lipid örneğini suya maruz bırakarak da oluşabileceğini gösterdi. Bu önemli bir ilerlemeydi, çünkü lipid çift katmanlarının kendiliğinden bir araya gelerek kendiliğinden oluştuğunu ve desenli bir destek yapısı gerektirmediğini gösterdi.
1977'de Kunitake ve Okahata tarafından tek bir organik bileşik olan didodesildimetilamonyum bromürden tamamen sentetik bir çift katmanlı membran hazırlandı. Açıkça iki katmanlı zarın van der Waals etkileşimi tarafından bir araya getirildiğini göstermektedir .
Ayrıca bakınız
Referanslar
Dış bağlantılar
- Avanti Lipids Lipidlerin en büyük ticari tedarikçilerinden biridir. Lipid özellikleri ve işleme ve lipid çift katmanlı hazırlama teknikleri hakkında teknik bilgiler.
- LIPIDAT Lipid fiziksel özelliklerinin kapsamlı bir veritabanı
- Sıvı Lipid Çift Katmanlarının Yapısı Lipid çift katmanlarının kesit yapısı ile ilgili simülasyonlar ve yayın bağlantıları.
- Lipid Bilayers ve Gramicidin Channel (Java eklentisi gerektirir) Lipid çift katmanlarının moleküler dinamik simülasyonlarının sonuçlarını gösteren resimler ve filmler.
- Irvine, California Üniversitesi'ndeki Stephen White laboratuvarından Sıvı Lipid Çift Katmanlarının Yapısı
- Lipid çift katmanlı dinamiklerinin animasyonları (Flash eklentisi gerektirir)