Yörünge hibridizasyonu - Orbital hybridisation
Olarak kimya , yörünge hibridizasyon (ya da hibridizasyon ) karıştırılması kavramı atom orbitalleri yeni oluşturmak üzere hibrid orbitalleri oluşturmak için elektron eşleştirme için (bileşen atom orbital daha vb farklı enerjilere, şekiller ile birlikte), uygun kimyasal bağlar olarak valans bağı teori . Örneğin, üç valanslı bir kabuğu p orbitalleri dört tekli bağlar valans-kabuk s yörünge birleştirir oluşturan bir karbon atomu dört eşdeğer sp oluşturmak için 3 , bir düzenlenmiş karışımları tetrahedral dört farklı atom bağı karbon çevresinde düzenleme. Hibrit orbitaller, aşağıdakilerin açıklanmasında faydalıdır:moleküler geometri ve atomik bağlanma özellikleri ve uzayda simetrik olarak yerleştirilmişlerdir. Genellikle hibrit orbitaller, karşılaştırılabilir enerjilerin atomik orbitallerinin karıştırılmasıyla oluşturulur.
Tarihçe ve kullanımlar
Kimyager Linus Pauling , atomik orbitalleri kullanarak metan (CH 4 ) gibi basit moleküllerin yapısını açıklamak için ilk olarak 1931'de hibridizasyon teorisini geliştirdi . Pauling, bir karbon atomunun bir s ve üç p orbitali kullanarak dört bağ oluşturduğuna dikkat çekti, böylece bir karbon atomunun dik açılarda (p orbitallerini kullanarak) üç bağ ve s yörüngesi keyfi bir yönde. Gerçekte metan, eşdeğer kuvvette dört CH bağına sahiptir. Herhangi iki bağ arasındaki açı , 109°28' (yaklaşık 109,5°) tetrahedral bağ açısıdır . Pauling, dört hidrojen atomunun varlığında, s ve p orbitallerinin, hibrit orbitaller olarak adlandırdığı dört eşdeğer kombinasyon oluşturduğunu varsaydı . Her bir hibrid sp gösterilir 3 kendi bileşimini gösterir ve dört CH bağları biri boyunca yönlendirilir. Bu kavram, bu tür basit kimyasal sistemler için geliştirildi, ancak yaklaşım daha sonra daha yaygın olarak uygulandı ve bugün organik bileşiklerin yapılarını rasyonelleştirmek için etkili bir buluşsal yöntem olarak kabul ediliyor . Lewis yapılarına eşdeğer basit bir yörünge resmi verir .
Hibridizasyon teorisi, organik kimyanın ayrılmaz bir parçasıdır , en zorlayıcı örneklerden biri Baldwin'in kurallarıdır . Reaksiyon mekanizmalarını çizmek için bazen iki elektronu paylaşan iki atomla klasik bir bağ resmine ihtiyaç duyulur. Hibridizasyon teorisi, alkenler ve metandaki bağları açıklar. Esas olarak orbital hibridizasyon ile kararlaştırılan p karakteri veya s karakteri miktarı, asitlik veya bazlık gibi moleküler özellikleri güvenilir bir şekilde tahmin etmek için kullanılabilir.
genel bakış
Yörüngeler, moleküller içindeki elektronların davranışının bir model temsilidir. Basit hibridizasyon durumunda, bu yaklaşım, Schrödinger denkleminin tam olarak çözülebildiği tek nötr atom olan hidrojen atomu için elde edilenlere benzer atomik orbitallere dayanmaktadır . Karbon, nitrojen ve oksijen gibi daha ağır atomlarda kullanılan atomik orbitaller, hidrojen için uyarılmış durum orbitallerine benzer şekilde 2s ve 2p orbitalleridir.
Hibrit orbitallerin, çeşitli oranlarda birbiri üzerine bindirilmiş atomik orbitallerin karışımları olduğu varsayılır. Örneğin metanda , her bir karbon – hidrojen bağını oluşturan C hibrit yörüngesi %25 s karakteri ve %75 p karakterinden oluşur ve bu nedenle hibritleştirilmiş sp 3 ( sp-üç olarak okunur) olarak tanımlanır . Kuantum mekaniği bu hibriti N(s + √ 3 pσ) formunda bir sp 3 dalga fonksiyonu olarak tanımlar; burada N bir normalizasyon sabitidir (burada 1/2) ve pσ bir sigma bağı oluşturmak üzere CH ekseni boyunca yönlendirilen ap orbitaldir . Bu örnekte katsayıların oranı (genel olarak λ ile gösterilir) √ 3'tür . Yana elektron yoğunluğu orbital ile bağlantılı dalga fonksiyonunun karesi ile orantılıdır, s-karakter p-yapısına oranı λ olan 2 s karakter veya p bileşeninin ağırlık N'dir = 3. 2 λ 2 = 3 /4.
Hibridizasyon türleri
sp 3
Hibridizasyon, atomların bakış açısından atomların bağlanmasını tanımlar. Bir tetrahedrally koordine karbon (ör için metan CH 4 ), C-4, hidrojen atomu bağa doğru simetri ile 4 orbitalleri sahip olmalıdır.
Carbon'un temel durum konfigürasyonu 1s 2 2s 2 2p 2 veya daha kolay okunabilir:
| C | ↑↓ | ↑↓ | ↑ | ↑ | |
| 1s | 2s | 2p | 2p | 2p |
Karbon atomu iki oluşturulması için, iki tek başına işgal p-tipi orbitalleri kullanabilir kovalent bağlar tekli, sonuçta iki hidrojen atomuna sahip metilen CH 2 , basit karbenini . Karbon atomu ayrıca, iki kez dolu 2s orbitalinden boş 2p orbitaline bir elektronun uyarılması (veya terfisi) ile dört hidrojen atomuna bağlanabilir ve dört tek başına dolu orbital üretebilir.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | 2s | 2p | 2p | 2p |
İki ek bağın oluşumuyla açığa çıkan enerji, gerekli uyarma enerjisini telafi etmekten daha fazla, dört CH bağının oluşumunu enerjik olarak destekler.
Kuantum mekanik olarak, en düşük enerji, dört bağın eşdeğer olması durumunda elde edilir, bu da bunların karbon üzerindeki eşdeğer orbitallerden oluşmasını gerektirir. Dört eş orbitalinin kümesi dört sp doğrusal valans kabuğun kombinasyonları (çekirdek orbitalleri neredeyse bağında asla s) ve p dalga fonksiyonları, olduğu elde edilebilir 3 melezler.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp 3 | sp 3 | sp 3 | sp 3 |
CH olarak 4 , dört sp 3 melez orbitaller çakışan hidrojen , dört, sonuçta 1s orbitalleri σ (sigma) bağlar eşit uzunluk ve mukavemet (dört tek kovalent bağlar olduğunu) gösterir.
sp 2
Diğer karbon bileşikleri ve diğer moleküller benzer şekilde açıklanabilir. Örneğin, eten (Cı 2 H 4 karbon arasında) sahip olan bir çift bağı temsil eder.
Bu molekül için karbon sp 2 hibritleşir, çünkü karbonlar arasındaki çift bağ için bir π (pi) bağı gereklidir ve karbon atomu başına sadece üç σ bağı oluşur. sp 2 hibridizasyonunda 2s orbitali, genellikle 2p x ve 2p y olarak gösterilen mevcut üç 2p orbitalinden sadece ikisi ile karıştırılır . Üçüncü 2p yörüngesi (2p z ) hibritlenmemiş halde kalır.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp 2 | sp 2 | sp 2 | 2p |
kalan bir p orbitali ile toplam üç sp 2 orbital oluşturur. Etilende ( eten ) iki karbon atomu , her bir karbon atomundan bir sp 2 orbitaliyle örtüşerek bir σ bağı oluşturur . Moleküler düzleme dik karbon atomları arasındaki π bağı, 2p–2p örtüşmesiyle oluşur. Her karbon atomu , tümü 120° bağ açılarına sahip, s-sp 2 örtüşmesiyle iki hidrojenle kovalent C-H bağları oluşturur . Hidrojen-karbon bağlarının tümü, deneysel verilerle uyumlu olarak, eşit güçte ve uzunluktadır.
sp
Alkinler gibi üçlü bağ içeren bileşiklerdeki kimyasal bağ sp hibridizasyonu ile açıklanır. Bu modelde, 2s orbitali üç p orbitalinden sadece biri ile karıştırılır,
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp | sp | 2p | 2p |
iki sp orbitali ve kalan iki p orbitaliyle sonuçlanır. Asetilen (etin) (C 2 H 2 ) içindeki kimyasal bağ, bir σ bağı oluşturan iki karbon atomu arasındaki sp-sp örtüşmesinden ve p-p örtüşmesiyle oluşturulan iki ek π bağından oluşur. Her bir karbon aynı zamanda hidrojene 180° açılarda bir σ s–sp örtüşmesiyle bağlanır.
Hibridizasyon ve molekül şekli
Hibridizasyon , bağlar arasındaki açılar yaklaşık olarak hibrit orbitaller arasındaki açılara eşit olduğu için molekül şeklini açıklamaya yardımcı olur . Bu, değerlik bağı veya yörünge teorilerinden ziyade deneysel kurallara dayalı moleküler geometriyi tahmin etmek için kullanılabilen değerlik kabuğu elektron çifti itme (VSEPR) teorisinin aksinedir .
sp x hibridizasyon
Ana grup elemanlarının değerlik orbitalleri , karşılık gelen oktet kuralına sahip bir s ve üç p orbital olduğundan, bu moleküllerin şeklini modellemek için sp x hibridizasyonu kullanılır.
| Koordinasyon numarası | Şekil | hibridizasyon | Örnekler |
|---|---|---|---|
| 2 | Doğrusal | sp hibridizasyonu (180°) | CO 2 |
| 3 | Üçgensel düzlem | sp 2 hibridizasyon (120°) | BCl 3 |
| 4 | dört yüzlü | sp 3 hibridizasyonu (109.5 °) | CCl 4 |
| yörüngeler arası açılar | |||
sp x d y hibridizasyonu
Geçiş metallerinin değerlik orbitalleri , karşılık gelen 18 elektron kuralına sahip beş d, bir s ve üç p orbital olduğundan, bu moleküllerin şeklini modellemek için sp x d y hibridizasyonu kullanılır. Bu moleküller, ilgili farklı d-orbitalleri nedeniyle aynı hibridizasyona karşılık gelen birden fazla şekle sahip olma eğilimindedir. Kare düzlemsel bir kompleksin boş bir p-orbitali vardır ve dolayısıyla 16 değerlik elektronu vardır.
| Koordinasyon numarası | Şekil | hibridizasyon | Örnekler |
|---|---|---|---|
| 4 | kare düzlemsel | sp 2 d hibridizasyon | PtCl 4 2− |
| 5 | trigonal bipiramidal | sp 3 d hibridizasyon | Fe(CO) 5 |
| Kare piramidal | MnCl 5 2− | ||
| 6 | oktahedral | sp 3 d 2 hibridizasyon | Mo(CO) 6 |
| 7 | beşgen bipiramidal | sp 3 d 3 hibridizasyon | ZrF 7 3– |
| kapaklı oktahedral | Maliye Bakanlığı 7 - | ||
| Kapaklı trigonal prizmatik | TaF 7 2− | ||
| 8 | Kare antiprizmatik | sp 3 d 4 hibridizasyon | Referans 8 - |
| on iki yüzlü | Mo(CN) 8 4− | ||
| Bicapped trigonal prizmatik | ZrF 8 4− | ||
| 9 | Üç başlı trigonal prizmatik | sp 3 d 5 hibridizasyon | ReH 9 2− |
| Kapaklı kare antiprizmatik |
sd x hibritleştirme
Düşük d elektron sayısına sahip bazı geçiş metali komplekslerinde , p-orbitalleri boştur ve bu moleküllerin şeklini modellemek için sd x hibridizasyonu kullanılır.
| Koordinasyon numarası | Şekil | hibridizasyon | Örnekler |
|---|---|---|---|
| 3 | Köşeli piramit | sd 2 hibridizasyon (90°) | CrO 3 |
| 4 | dört yüzlü | sd 3 hibridizasyon (70.5°, 109.5°) | TiC 4 |
| 5 | Kare piramidal | sd 4 hibridizasyon (65.9°, 114,1°) | Ta(CH 3 ) 5 |
| 6 | C 3v Üçgen prizmatik | sd 5 hibridizasyon (63.4°, 116.6°) | W(CH 3 ) 6 |
| yörüngeler arası açılar | |||
Hipervalent moleküllerin hibridizasyonu
sekizli genişleme
Bazı genel kimya ders kitaplarında, ilk olarak Pauling tarafından önerilen d-orbitalleri olan bir "genişletilmiş oktet" şeması kullanılarak 5 ve üzeri ana grup koordinasyonu için hibridizasyon sunulmaktadır. Bununla birlikte, böyle bir şema, hesaplamalı kimya hesaplamaları ışığında artık yanlış olarak kabul edilmektedir.
| Koordinasyon numarası | Şekil | hibridizasyon | Örnekler |
|---|---|---|---|
| 5 | trigonal bipiramidal | sp 3 d hibridizasyon | PF 5 |
| 6 | oktahedral | sp 3 d 2 hibridizasyon | SF 6 |
| 7 | beşgen bipiramidal | sp 3 d 3 hibridizasyon | EĞER 7 |
1990'da New South Wales Üniversitesi'nden Eric Alfred Magnusson, ikinci sıra ( dönem 3 ) elementlerin hipervalent bileşiklerinde bağlanmada d-orbital hibridizasyonun rolünü kesin olarak dışlayan, bir çekişme ve karışıklık noktasına son veren bir makale yayınladı . Karışıklığın bir kısmı, bu bileşikleri tanımlamak için kullanılan temel kümelerde d-fonksiyonlarının temel olması gerçeğinden kaynaklanmaktadır (veya makul olmayan derecede yüksek enerjiler ve çarpık geometriler ortaya çıkmaktadır). Ayrıca, d-fonksiyonunun moleküler dalga fonksiyonuna katkısı büyüktür. Bu gerçekler, d-orbitallerinin bağlanmaya dahil olması gerektiği şeklinde yanlış yorumlandı.
Rezonans
Hesaplamalı kimya ışığında, hibridizasyona ek olarak sigma bağ rezonansını çağırmak daha iyi bir tedavi olacaktır; bu, her rezonans yapısının kendi hibridizasyon şemasına sahip olduğu anlamına gelir. Tüm rezonans yapıları oktet kuralına uymalıdır .
| Koordinasyon numarası | rezonans yapıları |
|---|---|
| 5 | trigonal bipiramidal |

|
|
| 6 | oktahedral |

|
|
| 7 | beşgen bipiramidal |

|
izovalent hibridizasyon
İdeal hibrit orbitaller faydalı olabilse de, gerçekte çoğu bağ, ara karakterli orbitaller gerektirir. Bu, her tipteki (s, p, d) atomik orbitallerin esnek ağırlıklarını içerecek bir uzantı gerektirir ve moleküler geometri ideal bağ açılarından saptığında bağ oluşumunun nicel bir tasvirine izin verir. p-karakterinin miktarı tamsayı değerleriyle sınırlı değildir; yani, sp 2.5 gibi hibridizasyonlar da kolaylıkla tarif edilmektedir.
Bağ orbitallerinin hibridizasyonu, Bent'in kuralı ile belirlenir : "Atomik karakter, elektropozitif ikame edicilere yönelik orbitallerde yoğunlaşır".
Yalnız çiftleri olan moleküller
Yalnız çiftleri olan moleküller için, bağlanma orbitalleri izovalent sp x hibritleridir. Örneğin, sudaki oksijenin bağ oluşturan iki hibrit yörüngesi , 104,5°'lik yörüngeler arası açı verecek şekilde sp 4.0 olarak tanımlanabilir . Bu araçlar 20% karakteri ve% 80 s bir karaktere sahip ve olmadığını olmayan bir melez orbital bir s ve oksijen üzerinde dört p orbitallerine oksijen 2p alt kabuk sadece üç p orbitalleri içerdiği yapılmış olması anlamına gelmektedir. Yalnız çiftleri olan moleküllerin şekilleri şunlardır:
-
Köşeli piramit
- Üç izovalent bağ hibriti (>90°)
- Örneğin, NH 3
-
Kıvrılmış
- İki izovalent bağ hibriti (>90°)
- Örneğin, SO 2 , H 2 O
Bu gibi durumlarda, yalnız çiftleri temsil etmenin matematiksel olarak eşdeğer iki yolu vardır. Moleküler orbital teorisine benzer sigma orbitalleri ve pi simetrisi veya VSEPR teorisine benzer eşdeğer orbitaller ile temsil edilebilirler.
hipervalent moleküller
Yalnız çiftleri olan hipervalent moleküller için, bağlanma şeması bir hipervalent bileşene ve izovalent sp x bağ hibritlerinden oluşan bir bileşene bölünebilir . Hipervalent bileşen, p orbitalleri kullanan rezonans bağlarından oluşur. Aşağıdaki tablo, her şeklin iki bileşenle ve bunların ilgili açıklamalarıyla nasıl ilişkili olduğunu gösterir.
| İzovalent bağ hibritlerinin sayısı (kırmızı ile işaretlenmiştir) | ||||
|---|---|---|---|---|
| 2 | Bir | - | ||
| hipervalan bileşen | Doğrusal eksen (bir p orbital) |
tahterevalli | T şeklinde | Doğrusal |

|

|

|
||
| Kare düzlemsel ekvator (iki p orbital) |
Kare piramidal | kare düzlemsel | ||

|
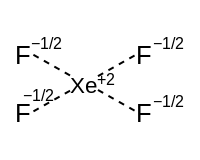
|
|||
| Beşgen düzlemsel ekvator (iki p orbital) |
beşgen piramidal | beşgen düzlemsel | ||

|

|
|||
Hibridizasyon kusurları
Etkili sp x hibritleri oluşturmak için s ve p orbitallerinin hibridizasyonu, karşılaştırılabilir radyal genişliğe sahip olmalarını gerektirir. 2p orbitalleri ortalama olarak 2s'den %10'dan daha büyükken, kısmen 2p orbitallerinde bir radyal düğüm olmamasına atfedilebilirken, bir radyal düğüme sahip 3p orbitalleri, 3s orbitallerini %20-33 oranında aşar. s ve p orbitallerinin kapsamındaki fark, bir grupta daha da artar. Kimyasal bağlardaki atomların hibridizasyonu, örneğin bir doğal bağ orbitali (NBO) şemasında doğal lokalize moleküler orbitaller kullanılarak, lokalize moleküler orbitaller dikkate alınarak analiz edilebilir . Olarak metan , CH 4 , hesaplanan P / S oranı, "ideal" sp ile yaklaşık 3 tutarlıdır 3 için ise, hibridizasyon silan , Si-H 4 daha yakın 2. benzer bir eğilim diğer 2p için görülür, s / s oranı olan elementler. Hidrojen yerine florin ikamesi p/s oranını daha da düşürür. 2p elemanları, ortogonal hibrit orbitallerle ideale yakın hibridizasyon sergiler. Daha ağır p blok elemanları için bu diklik varsayımı doğrulanamaz. İdeal hibridizasyondan bu sapmalar Kutzelnigg tarafından hibridizasyon kusurları olarak adlandırıldı .
fotoelektron spektrumları
Yörünge hibridizasyonu ile ilgili bir yanlış anlama , birçok molekülün ultraviyole fotoelektron spektrumlarını yanlış tahmin etmesidir . Koopmans teoremi lokalize hibritlere uygulanırsa bu doğru olsa da , kuantum mekaniği (bu durumda iyonize edilmiş) dalga fonksiyonunun molekülün simetrisine uymasını gerektirir, bu da değerlik bağ teorisinde rezonans anlamına gelir . Örneğin, metan, durumları (CH iyonize 4 + ) dört sp her birine elektron püskürtülen atfederek dört rezonans yapıları dışında yapılabilir 3 orbitalleri. Bir üç kat dejenere T yapılar, potansiyel sayısını muhafaza, bu dört yapıları doğrusal bir kombinasyon, 2 halde ve bir A 1 durum. Her iyonize durum ile temel durum arasındaki enerji farkı, deneysel sonuçlarla uyumlu iki değer veren iyonlaşma enerjisi olacaktır .
Yerelleştirilmiş ve kanonik moleküler orbitaller
Hibrit atomik orbitallerden oluşturulan bağ orbitalleri, moleküler orbital teorisinin delokalize orbitallerinden uygun bir matematiksel dönüşümle oluşturulabilen lokalize moleküler orbitaller olarak düşünülebilir. Temel durumdaki moleküller için, orbitallerin bu dönüşümü toplam çok elektronlu dalga fonksiyonunu değiştirmeden bırakır. Bu nedenle, temel durumun hibrit yörünge tanımı, temel durum toplam enerjisi ve elektron yoğunluğunun yanı sıra minimum toplam enerji değerine karşılık gelen moleküler geometri için delokalize yörünge tanımına eşdeğerdir .
İki yerelleştirilmiş temsil
Çoklu bağları veya çoklu yalnız çiftleri olan moleküller, sigma ve pi simetrisi veya eşdeğer orbitaller cinsinden temsil edilen orbitallere sahip olabilir. Farklı değerlik bağ yöntemleri, matematiksel olarak eşdeğer toplam çok elektronlu dalga fonksiyonlarına sahip olan ve işgal edilmiş moleküler orbitaller kümesinin üniter bir dönüşümü ile ilişkili olan iki gösterimden birini kullanır .
Çoklu bağlar için, sigma-pi gösterimi, eşdeğer yörünge ( bükülmüş bağ ) gösterimine kıyasla baskın olanıdır . Buna karşılık, birden fazla yalnız çift için, çoğu ders kitabı eşdeğer yörünge gösterimini kullanır. Bununla birlikte, sigma-pi gösterimi aynı zamanda, örneğin Weinhold ve Landis tarafından doğal bağ orbitalleri bağlamında , klasik (değerlik bağı/Lewis yapısı) bağ çiftlerinin ve yalnız çiftlerin modernize edilmiş analoglarını içeren yerelleştirilmiş bir yörünge teorisinde kullanılır. Örneğin hidrojen florür molekülü için, iki F yalnız çifti esasen hibritleşmemiş p orbitalleridir, diğeri ise bir sp x hibrit orbitaldir. Benzer bir değerlendirme su için de geçerlidir (bir O çifti saf p orbitalinde, diğeri sp x hibrit orbitalindedir).
Ayrıca bakınız
- kristal alan teorisi
- izovalent hibridizasyon
- Ligand alan teorisi
- Atomik orbitallerin lineer kombinasyonu
- MO diyagramları
- VALBOND









