Hassiyum - Hassium
| hassiyum | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz |
/ H æ s i ə m / ( dinleme ) |
||||||||||||||||||||
| Kütle Numarası | [269] (veriler belirleyici değil) | ||||||||||||||||||||
| Periyodik tablodaki Hassium | |||||||||||||||||||||
| |||||||||||||||||||||
| Atom numarası ( Z ) | 108 | ||||||||||||||||||||
| Grup | grup 8 | ||||||||||||||||||||
| Dönem | 7. dönem | ||||||||||||||||||||
| Engellemek | d-blok | ||||||||||||||||||||
| Elektron konfigürasyonu | [ Rn ] 5f 14 6d 6 7s 2 | ||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 18, 32, 32, 14, 2 | ||||||||||||||||||||
| Fiziki ozellikleri | |||||||||||||||||||||
| Faz de STP | katı (tahmin edilen) | ||||||||||||||||||||
| Yoğunluk ( rt yakın ) | 27-29 g / cm 3 (tahmin edilen) | ||||||||||||||||||||
| atomik özellikler | |||||||||||||||||||||
| oksidasyon durumları | (+2), ( +3 ), ( +4 ), (+6), +8 (parantezler: tahmin ) | ||||||||||||||||||||
| iyonlaşma enerjileri | |||||||||||||||||||||
| atom yarıçapı | ampirik: 126 pm (tahmini) | ||||||||||||||||||||
| kovalent yarıçap | 134 pm (tahmini) | ||||||||||||||||||||
| Diğer özellikler | |||||||||||||||||||||
| Doğal oluşum | sentetik | ||||||||||||||||||||
| Kristal yapı | hegzagonal sıkı paket (hcp)
(tahmin edildi) |
||||||||||||||||||||
| CAS numarası | 54037-57-9 | ||||||||||||||||||||
| Tarih | |||||||||||||||||||||
| adlandırma | Hassia'dan sonra , Hessen için Latince , Almanya, keşfedildiği yer | ||||||||||||||||||||
| keşif | Gesellschaft für Schwerionenforschung (1984) | ||||||||||||||||||||
| Hassium'un ana izotopları | |||||||||||||||||||||
| |||||||||||||||||||||
Hassiyum a, kimyasal element ile sembolü Hs ve atom numarası 108 hassiyum yüksek olan radyoaktif ; onun en istikrarlı bilinen izotopları vardır yarılanma ömürlerine yaklaşık on saniye. İzotopları biri 270 Hs vardır sihirli sayılar hem proton ve nötronları bunu karşı daha kararlı hale gelir ki, deforme çekirdekler için kendiliğinden fisyon . Hassium süper ağır bir elementtir ; o olmuştur laboratuarda üretilen sadece çok küçük miktarlarda füzyonu daha hafif olanlarla ağır çekirdekleri. Elementin doğal oluşumları varsayıldı, ancak hiçbir zaman bulunamadı.
Olarak periyodik tablonun elemanları, hassiyum a, transactinide elemanı , bir üyesi 7 bir süre ve grup 8 ; dolayısıyla 6d serisi geçiş metallerinin altıncı üyesidir . Kimya deneyleri daha ağır olarak hassiyum davranır doğruladı homologu için osmiyum , oksijen ile kolaylıkla reaksiyona uçucu oluşturmak üzere tetroksit . Hassiyumun kimyasal özellikleri sadece kısmen karakterize edilmiştir, ancak diğer grup 8 elementlerinin kimyası ile iyi bir şekilde karşılaştırılır .
Hassium'un keşfine yol açan başlıca yenilik, kaynaşmış çekirdeklerin önceki tekniklerde olduğu kadar kütle bakımından farklılık göstermediği soğuk füzyon tekniğiydi. Hedef çekirdeklerin daha fazla kararlılığına dayanıyordu, bu da uyarma enerjisini azalttı. Bu, sentez sırasında nötron atılımlarının sayısını azaltarak daha ağır, daha kararlı çekirdekler oluşturdu. Teknik ilk olarak 1974'te Dubna , Moskova Oblastı , Rusya SFSR , Sovyetler Birliği'ndeki Ortak Nükleer Araştırma Enstitüsü'nde (JINR) test edildi . JINR bu tekniği 1978, 1983 ve 1984'te element 108'in sentezini denemek için kullandı ; ikinci deney, element 108'in üretildiği iddiasıyla sonuçlandı . Daha sonra 1984'te, Darmstadt , Hesse , Batı Almanya'daki Gesellschaft für Schwerionenforschung'dan (GSI) bir sentez iddiası geldi . Uluslararası Temel ve Uygulamalı Kimya Birliği ve Uluslararası Temel ve Uygulamalı Fizik Birliği tarafından oluşturulan Transfermium Çalışma Grubu tarafından hazırlanan 1993 raporu , Darmstadt'tan gelen raporun kendi başına kesin olduğu, Dubna'dan gelen raporun ise kesin olmadığı ve büyük itibar gördüğü sonucuna vardı. Alman bilim adamlarına verildi. GSI , 1992 yılında tesise ev sahipliği yapan Alman Hessen eyaletinin (Latince Hassia) adını hassium elementine vermek istediklerini resmi olarak duyurdu ; bu isim 1997 yılında kesin kabul edilmiştir.
En ağır elementlere giriş

| Harici video | |
|---|---|
|
|
En ağır atom çekirdekleri , eşit olmayan büyüklükteki diğer iki çekirdeği bir araya getiren nükleer reaksiyonlarda oluşturulur; kabaca, kütle bakımından iki çekirdek ne kadar eşitsizse, ikisinin tepkime olasılığı o kadar artar. Daha ağır çekirdeklerden oluşan malzeme bir hedef haline getirilir ve daha sonra daha hafif çekirdeklerin ışını tarafından bombalanır . İki çekirdekleri can sadece sigorta biri yakından yeterince birbirini yaklaşırsa içine; normalde, çekirdekler (tümü pozitif yüklü) elektrostatik itme nedeniyle birbirini iter . Güçlü bir etkileşim ama sadece çekirdekten çok kısa bir mesafe içinde bu itmeyi üstesinden; Işın çekirdekleri bu nedenle, bu tür bir itmeyi, ışın çekirdeğinin hızına kıyasla önemsiz kılmak için büyük ölçüde hızlandırılır . İki çekirdeğin kaynaşması için tek başına yaklaşmak yeterli değildir: iki çekirdek birbirine yaklaştığında, genellikle yaklaşık 10 −20 saniye birlikte kalırlar ve daha sonra tek bir çekirdek oluşturmak yerine yollarını ayırırlar (reaksiyondan öncekiyle aynı bileşimde olması gerekmez). çekirdek. Füzyon meydana gelirse, bileşik çekirdek olarak adlandırılan geçici birleşme , uyarılmış bir durumdur . Bunu uyarım enerji kaybı ve daha istikrarlı bir durum, bir bileşik çekirdeği ya ulaşmak için fissions veya çıkacaktır bir veya birkaç nötronlar uzaklıkta enerji taşıyan,. Bu , ilk çarpışmadan yaklaşık 10-16 saniye sonra meydana gelir.
Işın hedeften geçer ve bir sonraki bölmeye, ayırıcıya ulaşır; yeni bir çekirdek üretilirse bu ışınla taşınır. Ayırıcıda, yeni üretilen çekirdek diğer nüklidlerden (orijinal ışının ve diğer reaksiyon ürünlerininki) ayrılır ve çekirdeği durduran bir yüzey bariyeri dedektörüne aktarılır . Dedektör üzerindeki yaklaşan darbenin tam yeri işaretlenir; ayrıca enerjisi ve varış zamanı da işaretlenmiştir. Aktarım yaklaşık 10 −6 saniye sürer ; tespit edilebilmesi için çekirdeğin bu kadar uzun süre hayatta kalması gerekir. Çekirdek, bozunması kaydedildikten sonra tekrar kaydedilir ve bozunmanın yeri, enerjisi ve zamanı ölçülür.
Bir çekirdeğin kararlılığı, güçlü etkileşim ile sağlanır. Ancak menzili çok kısadır; çekirdekler büyüdükçe, en dıştaki nükleonlar ( protonlar ve nötronlar) üzerindeki etkileri zayıflar. Aynı zamanda çekirdek, sınırsız menzile sahip olduğu için protonlar arasındaki elektrostatik itme ile parçalanır. En ağır elementlerin çekirdekleri bu nedenle teorik olarak tahmin edilir ve şimdiye kadar öncelikle bu tür bir itmenin neden olduğu bozunma modları yoluyla bozunduğu gözlemlenmiştir: alfa bozunumu ve kendiliğinden fisyon ; bu modlar, süper ağır elementlerin çekirdekleri için baskındır . Alfa bozunmaları, yayılan alfa parçacıkları tarafından kaydedilir ve bozunma ürünlerinin asıl bozunmadan önce belirlenmesi kolaydır; eğer böyle bir bozunma veya bir dizi ardışık bozunma bilinen bir çekirdek üretiyorsa, bir reaksiyonun orijinal ürünü aritmetik olarak belirlenebilir. Bununla birlikte, kendiliğinden fisyon, ürün olarak çeşitli çekirdekler üretir, bu nedenle orijinal nüklid kızlarından belirlenemez.
En ağır elementlerden birini sentezlemeyi amaçlayan fizikçilerin elindeki bilgiler, bu nedenle, dedektörlerde toplanan bilgilerdir: bir parçacığın dedektöre varış yeri, enerjisi ve zamanı ve bozunma bilgileri. Fizikçiler bu verileri analiz eder ve gerçekten de yeni bir elementten kaynaklandığı ve iddia edilenden farklı bir nüklidden kaynaklanamayacağı sonucuna varmaya çalışırlar. Genellikle, sağlanan veriler yeni bir unsurun kesinlikle yaratıldığı sonucuna varmak için yetersizdir ve gözlemlenen etkiler için başka bir açıklama yoktur; verilerin yorumlanmasında hatalar yapılmıştır.
keşif

Soğuk füzyon
1960'larda kullanılan nükleer reaksiyonlar, dört veya beş nötronun atılmasını gerektiren yüksek uyarma enerjileriyle sonuçlandı; bu reaksiyonlar, bir reaksiyonda iki çekirdek arasındaki boyut farkını en üst düzeye çıkarmak için yüksek atom numaralı elementlerden yapılmış hedefleri kullandı. Bu, hedef ve mermi arasındaki daha düşük elektrostatik itme nedeniyle füzyon şansını arttırırken, oluşan bileşik çekirdekler genellikle parçalandı ve yeni bir element oluşturmak için hayatta kalmadı. Ayrıca, daha ağır elementler kararlılığı en üst düzeye çıkarmak için proton başına daha fazla nötron gerektirdiğinden, füzyon süreçleri kaçınılmaz olarak nötrondan fakir çekirdekler üretir; bu nedenle, nötronların gerekli fırlatılması, tipik olarak daha kısa ömürleri olan nihai ürünlerle sonuçlanır . Bu nedenle, ışık ışınları (altı ila on proton), elementlerin sentezine yalnızca 106'ya kadar izin verdi .
Daha ağır elementler önceden için, Sovyet fizikçi Yuri Oganessian de Nükleer Araştırma Ortak Enstitüsü içinde (JINR) Dubna'da , Moscow Oblast , Rusya SFSR , Sovyetler Birliği , sahip olduğu, bombardımana çekirdeği kurşun-208 olacağını farklı bir mekanizmaya, önerilen sihirli sayıda proton ve nötron veya ona yakın başka bir çekirdek. Her proton ve nötronun sabit bir dinlenme enerjisi değeri vardır ; tüm protonlarınki eşittir ve tüm nötronlarınkiler de öyle. Bir çekirdekte, bu enerjinin bir kısmı bağlayıcı protonlara ve nötronlara yönlendirilir; bir çekirdeğin sihirli sayıda protonu ve/veya nötronu varsa, o zaman kalan enerjisinin daha da fazlası yönlendirilir, bu da nüklide ek stabilite sağlar. Bu ek kararlılık, harici bir çekirdeğin mevcut olanı kırması ve ona nüfuz etmesi için daha fazla enerji gerektirir. Bağlayıcı nükleonlara yönlendirilen daha fazla enerji, daha az dinlenme enerjisi anlamına gelir, bu da daha az kütle anlamına gelir (kütle, dinlenme enerjisiyle orantılıdır). Reaksiyona giren çekirdeklerin daha eşit atom numaraları, aralarında daha büyük elektrostatik itme ile sonuçlanır, ancak hedef çekirdeğin daha düşük kütle fazlalığı bunu dengeler. Bu, yeni oluşturulan bileşik çekirdek için daha az uyarma enerjisi bırakır, bu da kararlı bir duruma ulaşmak için daha az nötron fırlatmasını gerektirir. Bu enerji farkı nedeniyle, ilk mekanizma "sıcak füzyon" ve ikincisi "soğuk füzyon" olarak bilinir hale geldi.
Soğuk füzyon ilk olarak 1974'te JINR'de henüz keşfedilmemiş element 106'nın sentezi için test edildiğinde başarılı ilan edildi. Bu yeni çekirdeklerin kendiliğinden fisyon yoluyla bozunacağı tahmin edildi. JINR'deki fizikçiler, o sırada bilinen hiçbir fisyon çekirdeği, deney sırasında gözlemlenenlere benzer fisyon parametreleri göstermediğinden ve reaksiyonlardaki iki çekirdekten herhangi birinin değiştirilmesi, gözlemlenen etkileri olumsuz etkilediğinden, deneyde element 106'nın üretildiği sonucuna vardılar. Lawrence Berkeley Laboratuvarı'nda Fizikçiler (lbl; aslen Radyasyon Laboratuvarı, RL, ve daha sonra Lawrence Berkeley Ulusal Laboratuvarı , LBNL) ait Kaliforniya Üniversitesi de Berkeley , California , Amerika Birleşik Devletleri, aynı zamanda yeni teknikle büyük ilgi gösterdi. Sorulduğunda ne kadar bu yeni yöntem gidebiliriz ve kurşun hedefler olsaydı bir fiziğinin Klondike Klondike abartı olabilir", Oganessian yanıt verdi [...] Ama yakında, biz elemanları almaya çalışacağım 107 bunlarda ... 108 tepkiler."
Raporlar
Element 108'in sentezi ilk olarak 1978'de JINR'de Oganessian liderliğindeki bir araştırma ekibi tarafından denendi. Ekip , radyum füzyonundan (özellikle izotop) 108 numaralı elementi , özellikle izotop 270 108'i oluşturacak bir reaksiyon kullandı.226
88Ra
) ve kalsiyum (48
20CA
) . Araştırmacılar verilerini yorumlamada kararsızdı ve makaleleri açık bir şekilde elementi keşfettiklerini iddia etmedi. Aynı yıl, JINR'deki başka bir ekip, kurşun arasındaki reaksiyonlarda element 108'in sentez olasılığını araştırdı ( 208
82Pb
) ve demir (58
26Fe
) ; verileri yorumlamada kararsızlardı, bu da element 108'in yaratılmamış olma olasılığını akla getiriyordu .

1983 yılında JINR'de yeni deneyler yapıldı. Deneyler muhtemelen element 108'in senteziyle sonuçlandı ; bizmut (209
83Bi
) manganez bombardımanına tutuldu (55
25Mn
) elde etmek için 263 108, kurşun (207
82Pb
, 208
82Pb
) demir bombardımanına tutuldu (58
26Fe
) 264 108 elde etmek ve kaliforniyum (249
98bkz.
) neon ile bombalandı (22
10Ne
) elde etmek için 270 108. Bu deneylerin bir keşif olduğu iddia edilmedi ve Oganessian bunları yazılı bir rapordan ziyade bir konferansta duyurdu.
1984'te Dubna'daki JINR araştırmacıları, öncekilerle aynı şekilde kurulmuş deneyler yaptılar; bizmut ve kurşun hedefleri sırasıyla daha hafif elementler manganez ve demir ile bombaladılar. Yirmi bir spontan fisyon olayı kaydedildi; araştırmacılar, 264 108'in neden olduğu sonucuna vardılar .
Daha sonra 1984 yılında liderliğindeki araştırma ekibi Peter Armbruster ve Gottfried Münzenberg de Schwerionenforschung für Gesellschaft (GSI Ağır İyon Araştırma Enstitüsü olarak) Darmstadt , Hesse , Batı Almanya , öğe oluşturmak için çalıştı takım gol bombardımana 108. (208
82Pb
) hızlandırılmış demir ile hedef (58
26Fe
) çekirdekler. GSI'nin 108. elementi yaratma deneyi , 1982'de element 109'u yaratmalarından sonraya kadar ertelendi , çünkü önceki hesaplamalar , element 108'in bile-hatta izotoplarının kendiliğinden fisyon yarı ömürlerinin bir mikrosaniyeden daha az olacağını , bu da onların tespit edilmesini zorlaştıracağını ve tanımlamak. 108 numaralı element deneyi, 266 109 sentezlendikten ve alfa emisyonu ile bozunduğu tespit edildikten sonra nihayet devam etti , bu da element 108'in izotoplarının da aynı şeyi yapacağını düşündürdü ve bu, element 106'nın izotoplarını sentezlemeyi amaçlayan bir deneyle desteklendi. GSI, sentezi bildirdi. 265 108'lik üç atomdan oluşur. İki yıl sonra, çift-çift 264 108'in bir atomunun sentezini bildirdiler .
Tahkim
1985 yılında, Uluslararası Temel ve Uygulamalı Kimya Birliği (IUPAC) ve Uluslararası Temel ve Uygulamalı Fizik Birliği (IUPAP), keşifleri değerlendirmek ve atom numarası 100'den büyük olan elementlerin son isimlerini belirlemek için Transfermiyum Çalışma Grubunu (TWG) oluşturdu . Parti, rakip üç enstitüden delegelerle toplantılar yaptı; 1990'da bir elementin tanınması için kriterler belirlediler ve 1991'de keşifleri değerlendirme çalışmalarını bitirdiler ve dağıldılar. Bu sonuçlar 1993 yılında yayınlandı.
Rapora göre, JINR ve GSI'den gelen 1984 çalışmaları, aynı anda ve bağımsız olarak, element 108'in sentezini kurdu. 1984'teki iki eserden, GSI'den gelenin , kendi başına bir keşif olarak yeterli olduğu söylendi. GSI'den önce gelen JINR çalışması, "büyük olasılıkla" element 108'in sentezini sergiledi. Ancak bu, Darmstadt'taki çalışma göz önüne alındığında geçmişe bakıldığında belirlendi; JINR çalışması, element 108 izotoplarının uzak torunlarını kimyasal olarak tanımlamaya odaklandı (ki bu, bu kız izotoplarının başka progenitörlere sahip olma olasılığını dışlayamazdı), GSI çalışması ise bu element 108 izotoplarının bozunma yolunu açıkça tanımladı . Rapor, büyük kredinin GSI'ye verilmesi gerektiği sonucuna varmıştır. Bu karara verilen yazılı yanıtlarda hem JINR hem de GSI, kararın sonuçlarıyla aynı fikirdeydi. Aynı yanıtta GSI, kendilerinin ve JINR'nin aralarındaki tüm çatışmaları çözebildiklerini doğruladı.
adlandırma
Tarihsel olarak, yeni keşfedilen bir element, onu keşfeden tarafından adlandırılmıştır. İlk düzenleme, 1947'de, IUPAC'ın çelişkili isimler olması durumunda gerekli düzenlemeyi adlandırmaya karar vermesiyle geldi. Bu konular çözülebilir edildi Anorganik İsimlendirme Komisyonu ve Atom Ağırlıkları Komisyonu'nun . Bir çakışma olması durumunda isimleri gözden geçirip birini seçeceklerdi; karar, kullanım gibi bir dizi faktöre dayalı olacaktır ve bir talebin önceliğinin bir göstergesi olmayacaktır. İki komisyon, nihai otorite olacak IUPAC Konseyi'ne bir isim önerecek. Kaşifler bir elementi isimlendirme hakkına sahipti, ancak isimleri IUPAC'ın onayına tabi olacaktı. Atom Ağırlıkları Komisyonu çoğu durumda element isimlendirmesinden uzaklaştı.
Altında isimsiz ve keşfedilmemiş elemanları Mendeleev terminoloji , hassiyum "eka- olarak bilinecek osmiyum ", "periyodik tabloda osmiyum altında ilk elemanı" olarak (adlı Sanskritçe EKA anlamına gelen "bir"). 1979'da IUPAC, elementin "unniloctium" olarak adlandırılacağı ve buna karşılık gelen "Uno" sembolü , element keşfedilene ve keşif daha sonra onaylanana kadar yer tutucu olarak sistematik bir element adı ve kalıcı bir isim atanmasına ilişkin tavsiyeler yayınladı. karar verildi. Bu öneriler kimya camiasında geniş çapta takip edilmesine rağmen, sahadaki rakip fizikçiler onları görmezden geldi. E108 , (108) veya 108 sembolleriyle "108 elementi" olarak adlandırdılar ya da önerilen "hassium" adını kullandılar.
1990'da, birkaç elementin keşfedilmesi ve adlandırılmasının önceliğini oluşturmadaki bir çıkmazı kırma girişiminde, IUPAC inorganik kimya terminolojisinde , bir elementin varlığı belirlendikten sonra, keşifçilerin bir isim önerebileceğini yeniden doğruladı . (Ayrıca, Atom Ağırlıkları Komisyonu isimlendirme sürecinden çıkarıldı.) 1991'de yayınlanan bir element keşfi için kriterler üzerine ilk yayın, TWG tarafından tanınma ihtiyacını belirtti.
Resmi olarak tanınan Alman kaşifler olan Armbruster ve meslektaşları, tümü GSI tarafından keşfedildiği kabul edilen 107 ila 109 arasındaki elementler için 7 Eylül 1992'de bir adlandırma töreni düzenlediler . Bilim adamları element 108 için "hassium" adını önerdiler. Enstitünün bulunduğu Alman Hessen eyaleti için Latince Hassia adından türetilmiştir . Bu isim, IUPAC'a, 29 Eylül 1992'de imzalanan, elementlerin keşif iddialarının önceliği konusundaki kararlarına yazılı bir yanıt olarak önerildi.
108 nolu elemanın isimlendirilmesi işlemi, 101 nolu eleman ile başlayan bir dizi elemanın isimlendirilmesine yönelik daha büyük bir işlemin parçasıydı ; üç takım -JINR, GSI ve LBL- birkaç elementin keşfini ve bu elementleri isimlendirme hakkını talep etti. Bazen bu iddialar çatıştı; Bir keşfedicinin bir öğeyi adlandırma hakkına sahip olduğu düşünüldüğünden, keşif önceliği üzerindeki çatışmalar genellikle bu yeni öğelerin adları üzerindeki çatışmalarla sonuçlandı. Bu çatışmalar Transfermium Savaşları olarak bilinir hale geldi . 101'den itibaren tüm öğe kümesini adlandırmak için farklı öneriler ve bazen bir ekip tarafından başka biri tarafından keşfedilen öğeler için kullanılmak üzere önerilen adlar verdiler. Ancak, tüm öneriler eşit onayla karşılanmadı; takımlar birkaç kez isimlendirme önerilerini açıkça protesto etti.
1994 yılında, IUPAC İnorganik Kimya İsimlendirme Komisyonu, 108 numaralı elementin Alman fizikçi Otto Hahn'dan sonra "hahnium" (Hn) olarak adlandırılmasını tavsiye etti , bu yüzden elementlerin Hahn ve Lise Meitner'den sonra adlandırılması tavsiye edildi (GSI'nin önerisine göre element 109'un meitnerium olarak adlandırılması önerildi). ) nükleer fisyon ortak keşiflerini onurlandırarak yan yana olacaklar; IUPAC, Alman önerisinin belirsiz olduğunu düşündüklerini belirtti. GSI, bu önerinin, kaşife bir isim önerme hakkı verilmesine ilişkin uzun süredir devam eden sözleşmeye aykırı olduğunu söyleyerek protesto etti; Amerikan Kimya Derneği GSI destekledi. "Hahnium" adı, farklı Ha sembolüyle de olsa, Amerikalı bilim adamları tarafından JINR ile bir keşif anlaşmazlığı yaptıkları element 105 için zaten önerilmiş ve kullanılmıştı ; böylece kafa karıştırıcı isimlerin karıştırılmasını protesto ettiler. Kargaşanın ardından, IUPAC, rakip kurumlara ev sahipliği yapan üç ülkenin ulusal bağlı kuruluşlarından temsilcilerden özel bir komite kurdu; 1995'te yeni bir dizi isim ürettiler. Element 108'e tekrar hahnium adı verildi ; bu teklif de geri alındı. Nihai uzlaşmaya 1996'da ulaşıldı ve 1997'de yayınlandı; element 108, hassium (Hs) olarak adlandırıldı . Eşzamanlı olarak, dubnium adı (Db; JINR konumundan Dubna'dan) 105. elemente atandı ve hahnium ismi herhangi bir element için kullanılmadı.
110. element için darmstadtium'un yanı sıra bu adlandırmanın resmi gerekçesi, GSI'nin konumu için bir dizi coğrafi adı tamamlamasıydı; bu set, 19. yüzyılda europium ve germanium isimleriyle başlatılmıştı . Bu küme , Berkeley'de keşfedilen elementler için americium , californium ve berkelium'un daha önceki adlarına bir yanıt olarak hizmet edecektir . Armbruster, "Bu kötü gelenek Berkeley tarafından kuruldu. Avrupa için yapmak istedik" yorumunu yaptı. Daha sonra, 112 elementinin adlandırılması hakkında yorum yaparken Armbruster, "Alman bilim adamları ve Alman kasabalarıyla devam etmememizi sağlamak için her şeyi yaptım" dedi.
izotoplar
| İzotop | Yarım hayat | çürüme modu |
keşif yılı |
Keşif reaksiyonu |
|
|---|---|---|---|---|---|
| Değer | Referans | ||||
| 263 Hs | 760 μs | a, SF | 2009 | 208 Pb( 56 Fe,n) | |
| 264 Hs | 540 μs | a, SF | 1986 | 207 Pb( 58 Fe,n) | |
| 265 Hs | 1,96 ms | a, SF | 1984 | 208 Pb( 58 Fe,n) | |
| 265m Hs | 360 μs | α | 1995 | 208 Pb( 56 Fe,n) | |
| 266 Hs | 3,02 ms | a, SF | 2001 | 270 Ds(—,α) | |
| 266m Hs | 280 ms | α | 2011 | 270m Ds(—,α) | |
| 267 Hs | 55 ms | α | 1995 | 238 U( 34 S,5n) | |
| 267m Hs | 990 μs | α | 2004 | 238 U( 34 S,5n) | |
| 268 Hs | 1.42 sn | α | 2010 | 238 U( 34 S,4n) | |
| 269 Hs | 16 saniye | α | 1996 | 277 Cn(—,2α) | |
| 270 Hs | 9 saniye | α | 2003 | 248 Cm( 26 Mg,4n) | |
| 271 Hs | 10 saniye | α | 2008 | 248 Cm( 26 Mg,3n) | |
| 273 Hs | 510 ms | α | 2010 | 285 Fl(—,3α) | |
| 275 Hs | 200 ms | α | 2004 | 287 Fl(—,3α) | |
| 277 Hs | 12 ms | α | 2010 | 289 Fl(—,3α) | |
| 277m Hs | 130 sn | bilimkurgu | 2012 | 293m Sv (—,4α) | |
Hassium'un kararlı veya doğal olarak oluşan izotopları yoktur. Laboratuvarda ya iki atomun kaynaştırılması ya da daha ağır elementlerin bozunmasının gözlemlenmesi yoluyla birkaç radyoaktif izotop sentezlenmiştir. 2019 itibariyle, şimdiye kadar üretilen tüm hassiyum miktarı yüzlerce atom mertebesindeydi. On iki, bildirilmiştir 263 277 arasında değişen seri numaraları ile izotopların (272 istisna, 274, ve 276), dördü-hassiyum-265, -266, -267, ve -277-adres bilinen yarı dengeli durumları da, hassium-277'ninki doğrulanmadı. Bu izotopların çoğu, ağırlıklı olarak alfa bozunması yoluyla bozunur; bu, kapsamlı bozunma özelliklerinin mevcut olduğu tüm izotoplar için en yaygın olanıdır, tek istisna, kendiliğinden fisyona uğrayan hassium-277'dir. Daha hafif izotoplar genellikle iki hafif çekirdek arasındaki doğrudan füzyonla sentezlenirken, daha ağır izotoplar tipik olarak daha büyük atom numaralarına sahip çekirdeklerin bozunma ürünleri olarak gözlendi.
Atom çekirdeklerinin iyi kurulmuş nükleer kabukları vardır ve bu kabukların varlığı çekirdeğe ek stabilite sağlar. Bir çekirdeğin belirli nükleer kabukları tamamlayan sihirli sayılar adı verilen belirli sayıda protonu veya nötronu varsa, o zaman çekirdek çürümeye karşı daha kararlıdır. Bilinen en yüksek sihirli sayılar protonlar için 82 ve nötronlar için 126'dır. Bu kavram bazen bu sihirli sayılar arasında ek sayılar içerecek şekilde genişletilir, bu da bazı ek stabilite sağlar ve "alt kabukların" kapanmasını gösterir. Daha iyi bilinen daha hafif çekirdeklerin aksine, süper ağır çekirdekler deforme olur. 1960'lara kadar, sıvı damla modeli nükleer yapı için baskın açıklamaydı. Yaklaşık 280 nükleonlu çekirdekler için fisyon bariyerinin ortadan kalkacağını öne sürdü . Bu nedenle, çekirdekler onları stabilize edebilecek bir yapı oluşturamadan, kendiliğinden fisyonun neredeyse anında gerçekleşeceği düşünülüyordu; Z ≈ 103 olan çekirdeklerin uzun bir süre var olamayacak kadar ağır olduğu ortaya çıktı .
Daha sonraki nükleer kabuk modeli , yaklaşık üç yüz nükleonlu çekirdeklerin, çekirdeklerin kendiliğinden fisyona karşı daha dirençli olacağı ve öncelikle daha uzun yarı ömürleri olan alfa bozunmasına uğrayacağı ve bir sonraki çift sihirli çekirdeğin (büyüye sahip olduğu) bir kararlılık adası oluşturacağını ileri sürdü. hem protonların hem de nötronların sayısının) kararlılık adasının merkezinde Z = 110-114 civarında ve tahmin edilen sihirli nötron sayısı N = 184 civarında yer alması bekleniyor. beklenen; ayrıca uzun ömürlü aktinitlerle tahmin edilen ada arasındaki ara çekirdeklerin deforme olduğunu ve kabuk etkilerinden ek stabilite kazandığını gösterdiler. Alfa bozunmasına karşı kararlılık artışı da belirgin olsa da, kendiliğinden fisyona karşı kararlılığa ilave, kendiliğinden fisyona karşı özellikle büyük olmalıdır. Bir nüklid tablosunda, deforme olmuş çekirdekler için bu kararlılığa karşılık gelen bölgenin merkezi 270 Hs olarak belirlendi , 108'in deforme olmuş çekirdekler için protonlar için sihirli bir sayı olması bekleniyor - küresel olmaktan uzak çekirdekler - ve 162 sihirli bir sayı olması bekleniyordu. bu tür çekirdekler için nötron sayısı. Beklenen adaya daha yakın olanların yanı sıra daha hafif süper ağır çekirdekler üzerinde yapılan deneyler, çekirdekler üzerindeki kabuk etkilerinin önemini göstererek, kendiliğinden fisyona karşı önceden tahmin edilenden daha fazla kararlılık göstermiştir.
Teorik modeller, bazı hassiyum izotopları için , deforme çekirdekler için N = 162 ve küresel çekirdekler için N = 184'te öngörülen nötron kabuğu kapanışları arasında, A = 275 ve N = 168–170 civarında uzanacak bir kararsızlık bölgesi öngörür . Bu bölgedeki nüklidlerin düşük fisyon engel yüksekliklerine sahip olduğu ve bunun da kendiliğinden fisyona karşı kısa kısmi yarı ömürlerle sonuçlandığı tahmin edilmektedir . Bu tahmin, 277 Hs ve komşu izobar 277 Mt'nin gözlenen on bir milisaniye yarı ömrü ile desteklenir, çünkü tek nükleondan gelen engelleme faktörlerinin, aksi takdirde beklenenden çok daha düşük olduğu gösterilmiştir. Ölçülen yarı ömürler, çift-çift 276 Hs ve 278 Ds için tahmin edilenlerden bile daha düşüktür; bu , kabuk kapaklarından uzakta stabilitede bir boşluk ve belki de bu bölgedeki kabuk kapaklarında bir zayıflama olduğunu gösterir.
1991'de Polonyalı fizikçiler Zygmunt Patyk ve Adam Sobiczewski, 108'in deforme olmuş çekirdekler için bir proton sihirli sayısı ve 162'nin bu tür çekirdekler için bir nötron sihirli sayısı olduğunu tahmin ettiler. Bu, bu tür çekirdeklerin temel durumlarında kalıcı olarak deforme oldukları, ancak daha fazla deformasyona karşı yüksek, dar fisyon bariyerlerine ve dolayısıyla kendiliğinden fisyona karşı nispeten uzun yaşam sürelerine sahip oldukları anlamına gelir. 270 Hs için kabuk stabilizasyonu için hesaplamalı beklentiler , onu deforme olmuş çift sihirli bir çekirdek için umut verici bir aday yaptı. Deneysel veriler azdır, ancak mevcut veriler araştırmacılar tarafından N = 162'nin sihirli bir sayı olarak atanmasını desteklemek için yorumlanmıştır . Özellikle, bu sonuç 269 Hs, 270 Hs ve 271 Hs'nin bozunma verilerinden çıkarılmıştır . 1997'de Polonyalı fizikçi Robert Smolańczuk , 292 Hs izotopunun , tahmin edilen N = 184 kabuk kapanmasının bir sonucu olarak alfa bozunmasına ve kendiliğinden fisyona karşı en kararlı süper ağır çekirdek olabileceğini hesapladı .
Doğal oluşum
Hassium'un Dünya'da doğal olarak meydana geldiği bilinmemektedir; yarı ömürlerinin tüm bilinen izotopların hayır kısa yeterli ilkel hassiyum günümüze kadar gelebilmiştir olurdu. Bu, yeterince uzun ömürlü olmaları durumunda bazıları hala eser miktarlarda var olabilecek , bilinmeyen, daha uzun ömürlü izotopların veya nükleer izomerlerin var olma olasılığını dışlamaz . Erken 1914 de Alman fizikçi Richard Swinne elemanı önerilmektedir bir kaynağı olarak 108 X-ışınları olarak Grönland buz tabakasının . Swinne bu gözlemi doğrulayamasa ve bu nedenle keşif iddiasında bulunmasa da, 1931'de Z = 108 civarında biri de dahil olmak üzere uzun ömürlü transuranik elementlerin "bölgelerinin" varlığını önerdi .
1963 yılında daha önce ilkel varlığını iddia ettikleri Sovyet jeolog ve fizikçi Viktor Cherdyntsev, küriyum -247, eleman bulduğu iddiasıyla -spesifik 108 267 güya 400 ila 500 arasında bir yarı ömre sahip 108 izotopu, milyon yıl içinde doğal molibdenit ve geçici sergenium adını önerdi (sembol Sg); bu isim, kökenini İpek Yolu adından alır ve onun için " Kazakistan'dan geliyor" olarak açıklanmıştır . Sergenium'un osmiyuma daha ağır homolog olduğunu iddia etmesinin mantığı, sergenium içerdiği varsayılan minerallerin nitrik asitte kaynatıldığında osmiyuma benzer şekilde uçucu oksitler oluşturmasıydı .
Cherdyntsev'in bulguları Sovyet fizikçi Vladimir Kulakov tarafından Cherdyntsev'in sergenium'un iddia ettiği bazı özelliklerin o sırada mevcut nükleer fizikle tutarsız olduğu gerekçesiyle eleştirildi. Kulakov tarafından gündeme getirilen başlıca sorular, sergenium'un iddia edilen alfa bozunma enerjisinin, beklenenden çok sayıda büyüklük mertebesi altında olduğu ve verilen yarılanma ömrünün, iddia edilen bozunma ile bir nüklid alfa bozunması için tahmin edilenden sekiz büyüklük mertebesi daha kısa olduğuydu. enerji. Aynı zamanda, 10 16 yıllık bir bölgede düzeltilmiş bir yarı ömür imkansız olurdu çünkü bu, numunelerin yaklaşık yüz miligram sergenium içerdiğini ima ederdi. 2003 yılında, 4.5 MeV enerjili gözlenen alfa bozunmasının, 271 Hs civarında bir hassiyum izotopunun farklı hiperdeforme durumları arasındaki düşük enerjili ve kuvvetle arttırılmış bir geçişten kaynaklanabileceği öne sürülmüştür, bu nedenle doğada süper ağır elementlerin varlığını düşündürmektedir. en azından mümkün olmasa da mümkün.
2006'da Rus jeolog Alexei Ivanov, 271 Hs'lik bir izomerin yarı ömre sahip olabileceğini varsaymıştı.(2.5 ± 0.5) x 10 8 yaklaşık 4.4 enerjileriyle alfa parçacıklarının gözlem açıklar yaş, molibden ve bazı örneklerde MeV osmiridium . Bu izomer 271 Hs elde edilebilir Beta çürümesi ve 271 Bh ve 271 ile homolog olan, Sg, renyum doğada gerçekleştiyse renyum ve molibden ile birlikte molibdenit meydana gelebilecek sırasıyla ve molibden. Hassium, osmiyum ile homolog olduğu için, doğada varsa osmiridyumda osmiyum ile birlikte meydana gelmelidir. 271 Bh ve 271 Sg'nin bozunma zincirleri varsayımsaldır ve bu varsayımsal hassiyum izomerinin tahmin edilen yarı ömrü, yeterli herhangi bir miktarın Dünya'da kalması için yeterince uzun değildir. Güneş Sistemi Samanyolu'nun sarmal kollarından geçerken Dünya'da daha fazla 271 H'nin birikmiş olması mümkündür ; bu , Pasifik Okyanusu ve Finlandiya Körfezi'nin okyanus tabanlarında bulunan fazla plütonyum-239'u açıklayabilir . Bununla birlikte, 271 Hs ile zenginleştirilmiş minerallerin , kızları uranyum-235 ve kurşun-207'den fazla olduğu tahmin edilmektedir ; ayrıca kripton , zirkonyum ve ksenon gibi kendiliğinden fisyon sırasında oluşan farklı oranlarda elementlere sahip olacaklardı . Molibdenit ve osmirid gibi minerallerde hassiyumun doğal oluşumu teorik olarak mümkündür, ancak pek olası değildir.
2004 yılında JINR , Modane , Auvergne-Rhône-Alpes , Fransa'daki Modane Yeraltı Laboratuvarı'nda doğal hassium arayışına başladı ; bu, kozmik ışınlardan kaynaklanan parazitleri ve yanlış pozitifleri önlemek için yeraltında yapıldı . 2008-09'da, laboratuvarda yürütülen bir deney, doğal osmiyumda üçün üzerinde nötron çokluğu (bir nötron tarafından vurulduktan ve parçalandıktan sonra yayılan serbest nötronların sayısı) kayıtlı birkaç olayının saptanmasıyla sonuçlandı ve 2012- 13 Aralık'ta, bu bulgular laboratuvarda yürütülen başka bir deneyde yeniden doğrulandı. Bu sonuçlar, doğal hassiyumun doğada analitik kimya yoluyla tespitine izin verecek miktarlarda potansiyel olarak var olabileceğini ima etti, ancak bu sonuç, kayıtlı olayların atfedilebileceği uzun ömürlü bir hassiyum izotopunun olduğu açık bir varsayıma dayanmaktadır.
Yana 292 Hs alfa bozunması ve kendiliğinden fisyon karşı özellikle stabil olabilen bir aday doğada olarak, herhangi bir kabul edildi. Bununla birlikte, bu nüklidin, beta bozunmasına karşı çok kararsız olduğu ve 286 Hs gibi herhangi bir beta-kararlı hassiyum izotopunun, doğada gözlemlenemeyecek kadar diğer bozunma kanallarında çok kararsız olacağı tahmin edilmektedir. A 2012 arama 292 onun yanında doğada Hs homologu içinde Maier-Leibnitz Laboratuvarı'nda osmiyum Garching'deki , Bavyera , Almanya, bolca bulunduğu için bir üst limit ayarını, başarısız olduOsmiyum gramı başına 3 × 10 −15 gram hassium.
Öngörülen özellikler
Çeşitli hesaplamalar , periyodik yasa ile tutarlı olarak hassium'un şimdiye kadarki en ağır grup 8 elementi olması gerektiğini öne sürüyor . Özellikleri genellikle daha ağır bir osmiyum homologu için beklenenlerle eşleşmelidir; tüm transaktinidlerde olduğu gibi, rölativistik etkilerden birkaç sapmanın ortaya çıkması beklenir .
Hassium veya bileşiklerinin çok az özelliği ölçülmüştür; bunun nedeni, son derece sınırlı ve pahalı üretimi ve hassium'un (ve ebeveynlerinin) çok çabuk bozulmasıdır. Hassium tetroksitin adsorpsiyon entalpisi gibi birkaç tekil kimya ile ilgili özellik ölçülmüştür, ancak hassium metalinin özellikleri bilinmemektedir ve sadece tahminler mevcuttur.
göreli etkiler
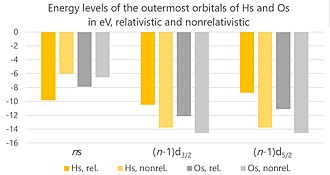
Hassium üzerindeki göreceli etkiler , çekirdeğinin etrafındaki elektronların daha hızlı hareket etmesine neden olan yüksek yükü nedeniyle ortaya çıkmalıdır - o kadar hızlı ki, hızları ışık hızıyla karşılaştırılabilir hale gelir. Üç ana etki vardır: doğrudan göreli etki, dolaylı göreli etki ve dönüş-yörünge bölünmesi . (Mevcut hesaplamalar Breit etkileşimlerini hesaba katmaz , ancak bunlar ihmal edilebilir düzeydedir ve bunların ihmal edilmesi, mevcut hesaplamalarda yalnızca %2'den fazla olmayan bir belirsizliğe neden olabilir.)
Atom numarası arttıkça, bir elektron ile çekirdek arasındaki elektrostatik çekim de artar. Bu, elektronun hızının artmasına neden olur ve bu da kütlesinde bir artışa yol açar . Bu da atomik orbitallerin , özellikle de s ve p 1/2 orbitallerinin büzülmesine yol açar . Elektronları atoma daha sıkı bağlanır ve çekirdekten çekilmesi zorlaşır. Bu doğrudan göreli etkidir. Başlangıçta sadece en içteki elektronlar için güçlü olduğu düşünülüyordu, ancak daha sonra değerlik elektronlarını da önemli ölçüde etkilemek için kuruldu.
s ve p 1/2 orbitalleri çekirdeğe daha yakın olduklarından, çekirdeğin elektrik yükünün daha büyük bir kısmını üzerlerine alırlar ("onu korur"). Bu, yörüngeleri genişleyen ve çekirdekten çekilmelerini kolaylaştıran kalan elektronların çekimi için daha az yük bırakır. Bu dolaylı rölativistik etkidir. Doğrudan ve dolaylı göreli etkilerin kombinasyonunun bir sonucu olarak, Hs + iyonu, nötr atomla karşılaştırıldığında, 7s elektronu yerine 6d elektronundan yoksundur. Karşılaştırıldığında, Os + , nötr atoma kıyasla 6s elektronundan yoksundur. Hassiyumun iyonik yarıçapı (+8 oksidasyon durumunda), bir Hs 8+ iyonu için en dış yörüngeler olan 6p 3/2 yörüngelerinin göreli genişlemesi nedeniyle osmiyumunkinden daha büyüktür (pratikte bu kadar yüksek yüklü iyonlar olmasına rağmen). kimyasal ortamlarda çok fazla gerçekliğe sahip olmak için çok kutuplaşmış olurdu).
s, p, d ve f harfleriyle gösterilen birkaç çeşit elektronik orbital vardır (g orbitallerinin, element 120'den sonra elementler arasında kimyasal olarak aktif olmaya başlaması beklenir ). Bir bu karşılık gelir her azimut kuantum sayısı l : elektron da tekabül 3. Her 1 ila p, d 2'dir ve f, 0 s , dönüş kuantum sayısı s ya +1/2 veya eşit olabilir, -1 /2. Böylece, toplam açısal momentum kuantum sayısı j = l + s , j = l ± 1/ 2'ye eşittir ( her yörüngedeki her iki elektron için j = 0 + 1/2 = 1/2 olan l = 0 hariç ) . Sıkma bir elektronun relativistik etkileşime farklı enerjilere ile (bir ile iki içine yörüngeye sahip ve bir alt dış kabuğunun bir bölünmeye bu etkileşim açar J = l - 1/2 enerji düşüktür ve özü daha zor ve böylece bu elektronların): örneğin altı 6p elektrondan ikisi 6p 1/2 ve dördü 6p 3/2 olur . Bu, spin-yörünge bölünmesidir (bazen alt kabuk bölünmesi veya jj eşleşmesi olarak da adlandırılır ). En çok hassiyum kimyasında önemli bir rol oynamayan p elektronlarında görülür, ancak d ve f elektronları için olanlar aynı büyüklük mertebesindedir (kantitatif olarak, enerji birimlerinde ifade edilen spin-yörünge bölünmesi, örneğin elektronvolt ).
Bu göreli etkiler, iyonlaşma enerjisinin beklenen artışından , elektron afinitesinin azalmasından ve osmiyum ile karşılaştırıldığında +8 oksidasyon durumunun stabilitesinin artmasından sorumludur ; onlar olmasaydı, eğilimler tersine dönerdi. Göreceli etkiler, hassium bileşiklerinin atomizasyon enerjilerini azaltır, çünkü d orbitalinin spin-yörünge bölünmesi elektronlar ve çekirdek arasındaki bağlanma enerjisini düşürür ve göreli etkiler, bağdaki iyonik karakteri azaltır .
Fiziksel ve atomik
8. grubun önceki üyeleri nispeten yüksek erime noktalarına sahiptir: Fe, 1538 °C; Ru , 2334 °C; Os, 3033 °C. Erime noktası tam olarak hesaplanmamış olmasına rağmen, onlara çok benzeyen hassium'un oda sıcaklığında katı olduğu tahmin edilmektedir. Hassium , daha hafif türdeş osmiyuma benzer şekilde, altıgen sıkı paketlenmiş yapıda ( c / a = 1.59) kristalleşmelidir . Saf metalik hassiyum bir olması hesaplanan kütle modülüne 450 (düzgün sıkıştırmaya direnç) GPa ile karşılaştırılabilir, elmas , 442 GPa. Hassiyum 27-29 g / cc bir yoğunluğa sahip öngörülen, 118 bilinen elementlerin en yoğun bir olması beklenmektedir 3 22.59 g / cm genel 3 osmiyum için ölçülmüştür.
Hassium'un atom yarıçapının 126 pm civarında olması bekleniyor . 7s orbitalinin göreli stabilizasyonu ve 6d orbitalinin destabilizasyonu nedeniyle, Hs + iyonunun 7s elektronu yerine 6d elektronu vererek [ Rn ] 5f 14 6d 5 7s 2 elektron konfigürasyonuna sahip olduğu tahmin edilmektedir. daha hafif homologlarının davranışının tersidir. Hs 2+ iyonunun, Os 2+ iyonu için hesaplanana benzer şekilde [Rn] 5f 14 6d 5 7s 1 elektron konfigürasyonuna sahip olması beklenir . Olarak kimyasal bileşikler , hassiyum bir için bağlama karakteristiğini teşhir etmek için hesaplanan d-Blok bağlama esas olarak 6d tarafından yürütülecek elemanı, 3/2 ve 6d 5/2 orbitalleri; 7s, 6p 1/2 , 6p 3/2 ve 7p 1/2 orbitalleri önceki dönemlerdeki elementlere göre daha önemli olmalıdır.
Kimyasal
| eleman | Kararlı oksidasyon durumları | |||||||
|---|---|---|---|---|---|---|---|---|
| Demir | +6 | +3 | +2 | |||||
| rutenyum | +8 | +6 | +5 | +4 | +3 | +2 | ||
| osmiyum | +8 | +6 | +5 | +4 | +3 | +2 | ||
Hassium, 6d serisi geçiş metallerinin altıncı üyesidir ve platin grubu metallere çok benzemesi beklenir . Bu özelliklerin bazıları gaz fazı kimya deneyleriyle doğrulandı. Grup 8 elementleri çok çeşitli oksidasyon durumlarını gösterir, ancak rutenyum ve osmiyum kolayca +8 grup oksidasyon durumunu gösterir; bu durum grup içinde daha kararlı hale gelir. Bu oksidasyon durumu son derece nadirdir: kararlı elementler arasında sadece rutenyum, osmiyum ve ksenon makul derecede kararlı bileşiklerde bunu elde edebilir. Hassium'un kendi türdeşlerini takip etmesi ve kararlı bir +8 durumuna sahip olması beklenir, ancak onlar gibi +6, +4, +3 ve +2 gibi daha düşük kararlı oksidasyon durumları göstermelidir. Hassium(IV)'ün sulu solüsyonda hassium(VIII)'den daha kararlı olması beklenir. Hassium oldukça asil bir metal olmalıdır . Standart indirgenme potansiyeli Hs için 4+ / HS çift 0.4 olması bekleniyor V.
Grup 8 elementleri, belirgin bir oksit kimyası gösterir. Tüm hafif elemanlar bilinen veya varsayımsal tetroksitlere, MO 4'e sahiptir . Gruptan aşağı inildikçe oksitleyici güçleri azalır. FeO 4 , olağanüstü büyük elektron ilgisi nedeniyle bilinmemektedir - bir elektron nötr bir atoma veya moleküle negatif bir iyon oluşturmak için eklendiğinde salınan enerji miktarı - bu da iyi bilinen oksianyon ferratının (VI) oluşumuyla sonuçlanır. , FeO2−
4. Rutenyum tetraoksit , Ruo 4 asit rutenyum (VI) 'nın oksidasyonu ile meydana gelir, kolaylıkla maruz azalma ruthenate (VI)' e Ruo2−
4. Rutenyum metalinin havadaki oksidasyonu, dioksit RuO 2'yi oluşturur . Bunun aksine, osmiyum yanıklar kararlı oluşturmak üzere tetroksit , OSO 4 hidroksit iyonu ile kompleksler, bir osmiyum (VIII) oluşturmak üzere, - yedi [OsO karmaşık 4 (OH) 2 ] 2 . Bu nedenle, hassium, bir hassate(VIII), [HsO 4 (OH) 2 ] 2− oluşturmak üzere hidroksit ile kompleksleşmeye uğrayan kararlı, çok uçucu bir tetroksit HsO 4 oluşturarak osmiyumun daha ağır bir homologu gibi davranmalıdır . Rutenyum tetroksit ve osmiyum tetroksit, simetrik tetrahedral moleküler geometrileri nedeniyle ve yük nötr oldukları için uçucudur ; hassium tetroxide benzer şekilde çok uçucu bir katı olmalıdır. Grup 8 tetroksitlerin uçuculuklarının eğilimi deneysel olarak RuO 4 < OsO 4 > HsO 4 olarak bilinir , bu da hesaplanan sonuçları doğrular. Özel olarak, hesaplanan entalpileri ait adsorpsiyon -the enerji için gereken yapışma , bir sıvı ya da katı çözünmüş bir gaz atomlar, moleküller, ya da iyonlarının yüzeye Hso -of 4 (45.4 -, ± 1) üzerinde kJ / mol kadar kuvars , −(46 ± 2) kJ/mol deneysel değeriyle çok iyi uyum sağlar .
deneysel kimya
Kimyasal araştırma için ilk hedef, tetroksitin oluşumuydu; rutenyum ve osmiyum, +8 oksidasyon durumunda kararlı bir bileşik sergileyen tek geçiş metalleri olan uçucu tetroksitler oluşturduğu için seçilmiştir. Gaz fazı kimyasal çalışmalar için bu seçimin başından beri açık olmasına rağmen, hassiyumun kimyasal karakterizasyonu uzun süre zor bir görev olarak kabul edildi. Hassiyum izotopları ilk olarak 1984'te sentezlenmiş olsa da, kimyasal çalışmalara izin verecek kadar uzun ömürlü bir hassiyum izotopunun sentezlenmesi 1996 yılına kadar değildi. Ne yazık ki, bu hassiyum izotopu, 269 Hs, 277 Cn'nin bozunmasından dolaylı olarak sentezlendi ; sadece dolaylı sentez yöntemleri kimyasal araştırmalar için uygun değildir, aynı zamanda 277 Cn izotopunu üreten reaksiyon düşük bir verime sahipti - kesiti sadece 1 pb idi - ve bu nedenle kimyasal bir araştırma için yeterli hassium atomu sağlamadı. 248 Cm( 26 Mg, x n) 274− x Hs ( x = 4 veya 5) reaksiyonunda 269 Hs ve 270 Hs'nin doğrudan sentezi daha umut verici görünüyordu çünkü bu reaksiyonun enine kesiti 7 pb'de biraz daha büyüktü . Bu verim, bohriumun kimyasal karakterizasyonu için kullanılan reaksiyonun veriminden yaklaşık on kat daha düşüktü . Hassium'un kimyasal olarak başarılı bir şekilde karakterize edilebilmesi için ışınlama, ayırma ve algılama için yeni tekniklerin tanıtılması gerekiyordu.
Rutenyum ve osmiyum, lantanit büzülmesi nedeniyle çok benzer kimyaya sahiptir, ancak demir onlardan bazı farklılıklar gösterir; örneğin, rutenyum ve osmiyum, metalin +8 oksidasyon durumunda olduğu kararlı tetroksitler oluşturmasına rağmen, demir oluşturmaz. Hassiyumun kimyasal karakterizasyonuna hazırlık olarak, araştırmalar demir yerine rutenyum ve osmiyuma odaklandı çünkü hassiyumun rutenyum ve osmiyuma benzer olması bekleniyordu, çünkü hassium hakkında tahmin edilen veriler bu ikisininkiyle yakından eşleşiyordu.
İlk kimya deneyleri, 2001 yılında sentetik osmiyum radyoizotopları 172 Os ve 173 Os referans olarak kullanılarak gaz termokromatografisi kullanılarak yapıldı . Deney sırasında, 248 Cm( 26 Mg,5n) 269 Hs ve 248 Cm( 26 Mg,4n) 270 Hs reaksiyonları kullanılarak yedi hassium atomu sentezlendi . Daha sonra, hassium tetroksit molekülleri oluşturmak için bir helyum ve oksijen gazları karışımı içinde ısıllaştırıldı ve oksitlendi.
- Hs + 2 O 2 → HsO 4
Hassiyum tetroksitin ölçülen çökelme sıcaklığı, birincisinin daha az uçucu olduğunu gösteren osmiyum tetroksitinkinden daha yüksekti ve bu, hassium'u sıkıca grup 8'e yerleştirdi. HsO 4 için adsorpsiyon entalpisi ölçüldü,−46 ± 2 kJ/mol , tahmin edilen değerden önemli ölçüde düşüktü,−36.7 ± 1.5 kJ/mol , OsO 4'ün HsO 4'ten daha uçucu olduğunu gösterir ve çok benzer oynaklıklara sahip olmaları gerektiğini ima eden daha önceki hesaplamalarla çelişir. Karşılaştırma için, OsO 4 değeri−39 ± 1 kJ/mol . (Deneysel verilere daha yakın bir eşleşme sağlayan hesaplamalar, 2008'deki deneyden sonra geldi.) Hassium tetroksitin , detektör için kullanılan kimyasallar olan silikon dioksit ile silisyum nitrür ile farklı şekilde etkileşime girmesi mümkündür ; Bu tür etkileşimler arasında bir fark olup olmadığını ve ölçümleri etkileyip etkilemediğini belirlemek için daha fazla araştırma gereklidir. Bu tür araştırmalar, nükleer özelliklerinden daha doğru ölçümler içerecektir 269 Ruo ile Hs ve karşılaştırmalar 4 OSO ek olarak 4 .
2004'te bilim adamları, osmiyum ile iyi bilinen bir reaksiyon olan sodyum hassat (VIII) oluşturmak için hasyum tetroksit ve sodyum hidroksiti reaksiyona soktular. Bu, bir hassiyum bileşiği ile sodyum hassat (VIII) oluşturan ilk asit-baz reaksiyonuydu:
-
HsO
4+ 2 NaOH → Na
2[HsO
4(AH)
2]
Mainz Üniversitesi'nden bir ekip, 2008 yılında, GSI'deki yeni TASCA tesisini kullanarak hassium atomlarının elektrodepozisyonunu incelemeyi planladı. Amaçları 226 Ra( 48 Ca,4n) 270 Hs reaksiyonunu kullanmaktı . GSI bilim adamları hassiyum (II) bileşiği hassocene sentezini ve özelliklerini incelemek için Tasca kullanmak umut vardı, Hs ( Cı- 5 , H 5 ) 2 , reaksiyonu 226 Ra ( 48 Ca, X , n). Bu bileşik, daha hafif bileşikler olan ferrosen , rutenosen ve osmosen ile benzerdir ve iki siklopentadienil halkasının, rutenosen ve osmosen gibi gölgelenmiş bir konformasyona sahip olması ve ferrosen gibi kademeli bir konformasyonda olmaması beklenir . Stabil ve oldukça uçucu bir bileşik olması beklenen Hassosen seçilmiştir, çünkü metal ve halkalar arasındaki bağ metalosenlerde yüksek + yerine çoğunlukla kovalent olmasına rağmen +2'lik düşük formal oksidasyon durumunda hassium'a sahiptir. Daha önce araştırılmış olan 8 durumu ve göreceli etkilerin düşük oksidasyon durumunda daha güçlü olması bekleniyordu. Hassosenin oldukça simetrik yapısı ve az sayıda atomu relativistik hesaplamaları kolaylaştırır. 2021 itibariyle, hassosene ilişkin deneysel bir rapor bulunmamaktadır.
Notlar
Referanslar
bibliyografya
- Audi, G.; Kondev, FG; Wang, M.; et al. (2017). "Nükleer özelliklerin NUBASE2016 değerlendirmesi" (PDF) . Çinli Fizik C . 41 (3): 030001. Bibcode : 2017ChPhC..41c0001A . doi : 10.1088/1674-1137/41/3/030001 . S2CID 126750783 . Arşivlenmiş orijinal (PDF) , 1 Ağustos 2020 tarihinde.
- Berber, RC; Greenwood, NN ; Hrynkiewicz, AZ; et al. (1993). "Transfermium elementlerinin keşfi" (PDF) . Saf ve Uygulamalı Kimya . 65 (8): 1757–1814. doi : 10.1351/pac199365081757 . S2CID 195819585 . 20 Eylül 2016 tarihinde orijinalinden arşivlendi (PDF) . Erişim tarihi: 7 Eylül 2016 .
- Beiser, A. (2003). Modern fizik kavramları (6. baskı). McGraw-Hill. ISBN'si 978-0-07-244848-1. OCLC 48965418 .
- Greenwood, NN; Earnshaw, A. (1997). Elementlerin Kimyası (2. baskı). Butterworth-Heinemann . ISBN'si 978-0-08-037941-8.
- Hoffman, DC ; Ghiorso, A .; Seaborg, GT (2000). Transuranyum İnsanlar: İç Hikaye . Dünya Bilimsel . ISBN'si 978-1-78-326244-1.
- Hoffman, DC; Lee, DM; Pershina, V. (2006). "Transactinides ve gelecekteki unsurlar". Morss, LR'de; Edelstein, NM; Fuger, J. (ed.). Actinide ve Transactinide Elementlerin Kimyası (3. baskı). Springer Bilim+İş Medyası . s. 1652 –1752. ISBN'si 978-1-4020-3555-5.
- Kragh, H. (2018). Transuranikten Süper Ağır Elementlere: Bir Anlaşmazlık ve Yaratılış Hikayesi . Springer . ISBN'si 978-3-319-75813-8.
- Lide, DR (2004). Kimya ve fizik el kitabı (84. baskı). CRC Basın. ISBN'si 978-0-8493-0566-5.
- Zagrebaev, V.; Karpov, A.; Greiner, W. (2013). "Süper ağır element araştırmasının geleceği: Önümüzdeki birkaç yıl içinde hangi çekirdekler sentezlenebilir?" . Fizik Dergisi: Konferans Serisi . 420 (1): 01001. arXiv : 1207.5700 . Bibcode : 2013JPhCS.420a2001Z . doi : 10.1088/1742-6596/420/1/012001 . ISSN 1742-6588 . S2CID 55434734 .
Dış bağlantılar
-
 İlgili Medya hassiyum Wikimedia Commons
İlgili Medya hassiyum Wikimedia Commons