formilasyon - Formylation
Biyokimyada bir formil fonksiyonel grubunun eklenmesine formilasyon denir . Bir formil fonksiyonel grup, hidrojene bağlı bir karbonilden oluşur. Bir R grubuna eklendiğinde , bir formil grubuna aldehit denir .
Formilasyon, birkaç kritik biyolojik süreçte tanımlanmıştır. Metiyonin ilk olarak 1964'te Marker ve Sanger tarafından E. coli'de formillenmiş olarak keşfedildi ve daha sonra bakteri ve organellerde protein sentezinin başlatılmasında yer aldığı belirlendi. N- formilmetioninin oluşumu, metionil-tRNA Met transformilaz enzimi tarafından katalize edilir . Ek olarak, pürinlerin de novo biyosentezinde iki formilasyon reaksiyonu meydana gelir . Bu reaksiyonlar, glisinamid ribonükleotid (GAR) transformilaz ve 5-aminoimidazol-4-karboksiamid ribotid (AICAR) transformilaz enzimleri tarafından katalize edilir . Daha yakın zamanlarda, formilasyonun, gen ekspresyonunu modüle edebilen bir histon modifikasyonu olduğu keşfedilmiştir .
Genel formilasyon reaksiyonu
Formilasyon, bir bileşiğin bir formil grubu (-CH=O) ile işlevselleştirildiği herhangi bir kimyasal işlem anlamına gelir. Organik kimyada terimi en sık ile ilgili olarak kullanılan aromatik bileşiklerin (örneğin dönüşüm benzen için benzaldehit içinde Gattermann Koch reaksiyonu ). Biyokimyada reaksiyon, formiltransferazlar gibi enzimler tarafından katalize edilir .
Biyolojide formilasyon reaksiyonları
metanojenez
Metanofuranın formilasyonu metanojenez döngüsünü başlatır . Formil grubu karbon dioksitten türetilir ve metana dönüştürülür .

Protein sentezinde formilasyon
Bakterilerde ve organellerde, protein sentezinin başlaması, formil-metionil-tRNA (tRNA fMet ) oluşumu ile bildirilir . Bu reaksiyon, 10-formiltetrahidrofolata ve metionil-tRNA formiltransferaz enzimine bağlıdır. Bakteriyel olmayan hücrelerde tRNA fMet'in varlığı müdahaleci malzeme olarak adlandırıldığı ve hızla ortadan kaldırıldığı için bu reaksiyon ökaryotlar veya Archaea tarafından kullanılmaz . Üretiminden sonra tRNA fMet , protein sentezini başlatmak için ribozomun 30S alt birimine iletilir . fMet, metiyonin ile aynı kodon dizisine sahiptir. Bununla birlikte, fMet sadece protein sentezinin başlatılması için kullanılır ve bu nedenle sadece proteinin N ucunda bulunur. Dinlenme translasyonu sırasında metiyonin kullanılır. Olarak , E. coli , tRNA fMet özellikle tarafından tanınan başlatma faktörü IF-2 formil grubu blok metionin, N-terminalinde bir bağ oluşumu peptit olarak,.
Protein sentezi gerçekleştirildikten sonra, metiyonin üzerindeki formil grubu, peptit deformilaz ile uzaklaştırılabilir . Metionin kalıntısı, metionin aminopeptidaz enzimi ile daha da uzaklaştırılabilir .
Pürin biyosentezinde formilasyon reaksiyonları
Purin ribonükleotidleri AMP ve GMP'nin öncüsü olan inozin monofosfatın (IMP) on bir adımlı de novo sentezinde iki formilasyon reaksiyonu gereklidir . Glisinamid ribonükleotit (GAR) transformilaz , yolun dördüncü reaksiyonunda GAR'ın formilglisinamidin ribotide (FGAR) formilasyonunu katalize eder. De novo purin biyosentezinin sondan bir önceki adımında, 5-aminoimidazol-4-karboksiamid ribotid (AICAR), AICAR transformilaz tarafından 5-formaminoimidazol-4-karboksamid ribotide (FAICAR) formillenir .
GAR transformilaz
PurN GAR transformilaz, ökaryotlarda ve prokaryotlarda bulunur. Bununla birlikte, ikinci bir GAR transformilazı olan PurT GAR transformilaz, E. coli'de tanımlanmıştır . İki enzimin dizi koruması yoktur ve farklı formil donörleri gerektirirken, GAR için spesifik aktivite ve Km, hem PurT hem de PurN GAR transformilazında aynıdır.
PurN GAR transformilaz
PurN GAR transformilaz 1CDE, GAR'ın a-amino grubunu formüle etmek için bir formil donörü olarak koenzim N10-formiltetrahidrofolat (N10-formil-THF) kullanır. Ökaryotlarda PurN GAR transformilaz, çok işlevli büyük bir proteinin parçasıdır, ancak prokaryotlarda tek bir protein olarak bulunur.
mekanizma

Formilasyon reaksiyonunun, GAR'ın amin grubunun, N10-formil-THF'ye tetrahedral bir ara madde oluşturarak saldırdığı bir doğrudan transfer reaksiyonu yoluyla meydana gelmesi önerilmektedir. GAR'ın a-amino grubu nispeten reaktif olduğundan, nükleofilin protonsuzlaştırılmasının çözücü ile gerçekleşmesi önerilmektedir. Aktif sahada Asn 106, His 108 ve Asp 144 formil transferine yardımcı olacak şekilde konumlandırılmıştır. Bununla birlikte, mutajenez çalışmaları, yalnızca iki veya daha fazla kalıntının mutasyonları enzimi inhibe ettiğinden, bu kalıntıların kataliz için ayrı ayrı gerekli olmadığını göstermiştir. Yapıya dayalı olarak, negatif yüklü Asp144'ün His108'in pKa'sını arttırdığına ve His108'in protonlanmış imidazolyum grubunun N10-formil-THF formil grubunun elektrofilliğini arttırmasına izin verdiğine inanılmaktadır. Ek olarak, His108 ve Asn106'nın geçiş durumunda oluşan oksianyonu stabilize ettiğine inanılmaktadır.
PurT GAR transformilaz
PurT GAR transformilaz, formil donörü olarak format ve kataliz için ATP gerektirir. PurT GAR transformilazının E. coli'deki GAR formilasyonlarının %14-50'sini gerçekleştirdiği tahmin edilmektedir . Enzim, proteinlerin ATP-kavrama süper ailesinin bir üyesidir.
mekanizma
PurT GAR transformilaz için, kısa ömürlü bir formil fosfat ara maddesinin ilk form için önerildiği sıralı bir mekanizma önerilmiştir. Bu formil fosfat ara ürünü daha sonra formil grubunun transferi için GAR amin tarafından nükleofilik saldırıya uğrar. Mutagenez deneylerinde, mutant PurT GAR transforimilazın format için zayıf bir afiniteye sahip olduğu bir formil fosfat ara maddesi tespit edilmiştir. PurT GAR transformilazın formil fosfat, ADP ve GAR ile inkübe edilmesi, hem ATP hem de FGAR verir. Bu ayrıca formil fosfatın enzimde formilasyon reaksiyonunu gerçekleştirmek için kinetik ve kimyasal olarak yetkin olduğu için bir ara madde olabileceğini gösterir. Pozisyonel izotop değişim çalışmalarına dayalı olarak formilfosfat ara maddesinden önce gelen bir enzim fosfat ara maddesinin de oluşturulması önerilmiştir. Bununla birlikte, yapısal veriler, formatın, formilfosfat ara ürününü oluşturmak üzere enzimin aktif bölgesindeki ATP'nin y-fosfatına doğrudan bir saldırı için konumlandırılabileceğini gösterir.
AICAR transformilaz
AICAR transformilaz, AICAR'ın FAICAR'a formilasyonu için formil donörü olarak koenzim N10-formiltetrahidrofolat (N10-formil-THF) gerektirir. Bununla birlikte, AICAR transformilaz ve GAR transformilaz, yüksek bir dizi benzerliğini veya yapısal homolojiyi paylaşmaz.
mekanizma
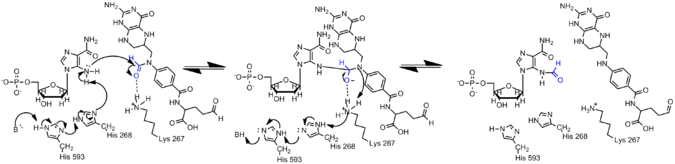
AICAR'daki amin, konjugasyon yoluyla AICAR'daki elektronların delokalizasyonu nedeniyle GAR'daki muadilinden çok daha az nükleofiliktir. Bu nedenle, formilasyon reaksiyonunun gerçekleşmesi için AIRCAR'ın N5 nükleofilinin aktive edilmesi gerekir. Histidin 268 ve Lizin 267'nin kataliz için gerekli olduğu bulunmuştur ve tüm AICAR transformilazlarında korunur. Histidin 268, AICAR'ın N5 nükleofilinin deprotonasyonunda yer alırken, Lysine 267'nin tetrahedral ara ürünü stabilize etmesi önerilmiştir.
Histon Proteinlerinde Formilasyon
ε-Formilasyon, kromatin konformasyonlarını ve gen aktivasyonunu modüle ettiği gösterilen histon proteinlerinde meydana gelen birçok translasyon sonrası modifikasyondan biridir .
Histonlar ve proteinlerdeki lizin kalıntılarının Nε'sinde formilasyon tanımlanmıştır. Bu modifikasyon, bağlayıcı histonlarda ve yüksek mobilite grubu proteinlerinde gözlenmiştir , oldukça boldur ve kromatin fonksiyonunun epigenetiğinde rolü olduğuna inanılmaktadır. Formüle edilen lizinlerin DNA bağlanmasında rol oynadığı gösterilmiştir. Ek olarak, asetillenmiş ve metillenmiş olduğu da bilinen histon lizinlerinde formilasyon tespit edilmiştir. Bu nedenle, formilasyon, diğer translasyon sonrası modifikasyonları bloke edebilir. Formilasyon en sık olarak Histon H1 üzerindeki 19 farklı modifikasyon bölgesinde tespit edilir. Hücrenin genetik ifadesi, kanser gibi hastalıklara neden olabilen formilasyon tarafından büyük ölçüde bozulur. Bu modifikasyonların gelişimi oksidatif strese bağlı olabilir.
Histon proteinlerinde, lisin tipik olarak Histon Asetil-Transferazlar (HAT'ler) ve Histon Deasetilazlar (HDAC veya KDAC) tarafından modifiye edilir. Lisinin asetilasyonu, belirli genlerin düzenlenmesi ve ekspresyonu için esastır. Oksidatif stres, formilfosfat türlerinin yüksek reaktivitesinden dolayı asetil-lizinin, formil-lizin oluşumuyla rekabette hızla yenildiği önemli ölçüde farklı bir ortam yaratır. Bu durumun şu anda oksidatif DNA hasarından kaynaklandığına inanılmaktadır. Oksidatif olarak hasar görmüş DNA'ya yüksek oranda bağımlı olan ve esas olarak hücre içindeki radikal kimya tarafından yönlendirilen formilfosfat oluşumu için bir mekanizma önerilmiştir. Üretilen formilfosfat daha sonra lisini formillemek için kullanılabilir. Oksidatif stresin, proteinlerin yüzeyindeki lizin kalıntılarının mevcudiyetinde ve formilasyon olasılığında rol oynadığına inanılmaktadır.
tıpta formilasyon
Bir ilaç hedefi olarak formilasyon reaksiyonları
Pürin biyosentezinde yer alan enzimlerin inhibisyonu, kemoterapi için potansiyel bir ilaç hedefi olarak kullanılmıştır.
Kanser hücreleri, bölünmeyi kolaylaştırmak için yüksek konsantrasyonlarda pürin gerektirir ve nükleotid kurtarma yolundan ziyade de novo senteze güvenme eğilimindedir . GAR transformilaz ve AICAR transformilaz tarafından formilasyon reaksiyonlarını inhibe etmek için birkaç folat bazlı inhibitör geliştirilmiştir. İlk GAR transformilaz inhibitörü Lometrexol [(6R)5,10-dideazatetrahidrofolat], 1980'lerde Eli Lilly ve akademik laboratuvarlar arasındaki işbirliği sayesinde geliştirildi .
Yapı olarak N10-formil-THF'ye benzer olmasına rağmen, lometreksol bir karbon transfer reaksiyonu gerçekleştiremez. Ek olarak, birkaç GAR bazlı GAR transformilaz inhibitörü de sentezlenmiştir. Folat bazlı inhibitörlerin geliştirilmesinin özellikle zor olduğu bulunmuştur, çünkü inhibitörler ayrıca , artan enzim afinitesi için hücreye girdikten sonra monoglutamat folatlara ve antifolatlara ilave y-glutamatlar ekleyen folipoliglutamat sentaz enzimini de aşağı düzenler . Bu artan afinite, antifolat direncine yol açabilir.
Leigh Sendromu
Leigh sendromu, enzimatik bir formilasyon reaksiyonundaki bir kusurla bağlantılı olan nörodejeneratif bir hastalıktır. Leigh sendromu tipik olarak mitokondride meydana gelen oksidatif fosforilasyondaki kusurlarla ilişkilidir. Exome sekanslama , Leigh sendromlu hastalarda mitokondriyal metionil-tRNA formiltransferaz (MTFMT) için gen kodlayan bir mutasyonu tanımlamak için kullanılmıştır. MTFMT'de tanımlanan ve Leigh Sendromunun semptomlarını veren c.626C>T mutasyonunun, bir çerçeve kayması mutasyonuna ve erken bir durdurma kodonuna yol açan ekzon eklemesini değiştirdiğine inanılmaktadır. MTFMT c.626C>T mutasyonu olan bireylerin, fMet-tRNAMet seviyelerinin ve mitokondrik olarak çevrilmiş COX1'in formilasyon seviyesindeki değişikliklerin azaldığı bulundu. Bu bağlantı, belirli mitokondriyal genler için ekspresyonun başlatılmasında formillenmiş metioninin gerekliliğine dair kanıt sağlar.