Alüminyum klorür - Aluminium chloride
 Alüminyum triklorür heksahidrat, (üstte) saf ve (altta) Demir(III) klorür ile kontamine
|
|||
|
|
|||
| İsimler | |||
|---|---|---|---|
|
IUPAC adı
alüminyum klorür
|
|||
| Diğer isimler
alüminyum(III) klorür
alüminyum triklorür |
|||
| tanımlayıcılar | |||
|
3B model ( JSmol )
|
|||
| chebi | |||
| Kimyasal Örümcek | |||
| ECHA Bilgi Kartı |
100.028.371 |
||
| AT Numarası | |||
| 1876 | |||
|
PubChem Müşteri Kimliği
|
|||
| RTECS numarası | |||
| ÜNİİ | |||
|
CompTox Panosu ( EPA )
|
|||
|
|||
| Özellikler | |||
| AlCl 3 | |||
| Molar kütle | 133.341 g/mol (susuz) 241.432 g/mol (hekzahidrat) |
||
| Dış görünüş | beyaz veya soluk sarı katı, higroskopik |
||
| Yoğunluk | 2.48 g / cm ' 3 (susuz) 2.398 g / cm' 3 (heksahidrat) |
||
| Erime noktası | 180 °C (356 °F; 453 K) (susuz, süblimleşir) 100 °C (212 °F; 373 K) (heksahidrat, dec.) |
||
| 439 g/l (0 °C) 449 g/l (10 °C) 458 g/l (20 °C) 466 g/l (30 °C) 473 g/l (40 °C) 481 g/l ( 60 °C) 486 g/l (80 °C) 490 g/l (100 °C) |
|||
| çözünürlük | hidrojen klorür, etanol, kloroform, karbon tetraklorürde çözünür Benzende az çözünür |
||
| Buhar basıncı | 133.3 Pa (99 °C) 13,3 kPa (151 °C) |
||
| viskozite | 0,35 cP (197 °C) 0,26 cP (237 °C) |
||
| Yapı | |||
| Monoklinik , mS16 | |||
| C12/m1, No.12 | |||
|
a = 0,591 nm, b = 0,591 nm, c = 1.752 nm
|
|||
|
Kafes hacmi ( V )
|
0,52996 mil 3 | ||
|
Formül birimleri ( Z )
|
6 | ||
| Oktahedral (katı) Dörtyüzlü (sıvı) |
|||
| Üçgen düzlemsel ( monomerik buhar) |
|||
| Termokimya | |||
|
Isı kapasitesi ( C )
|
91.1 J/mol·K | ||
|
Std molar
entropi ( S |
109.3 J/mol·K | ||
|
Std
oluşum entalpisi (Δ f H ⦵ 298 ) |
-704.2 kJ/mol | ||
|
Gibbs serbest enerjisi (Δ f G ˚)
|
-628,8 kJ/mol | ||
| Farmakoloji | |||
| D10AX01 ( WHO ) | |||
| Tehlikeler | |||
| Güvenlik Bilgi Formu | Bakınız: veri sayfası | ||
| GHS piktogramları |
 
|
||
| GHS Sinyal kelimesi | Tehlike | ||
| H314 | |||
| P280 , P310 , P305+351+338 | |||
| NFPA 704 (ateş elmas) | |||
| Ölümcül doz veya konsantrasyon (LD, LC): | |||
|
LD 50 ( ortalama doz )
|
susuz: 380 mg/kg, sıçan (oral) heksahidrat: 3311 mg/kg, sıçan (oral) |
||
| NIOSH (ABD sağlığa maruz kalma sınırları): | |||
|
PEL (İzin Verilebilir )
|
Yok | ||
|
REL (Önerilen)
|
2 mg / m 3 | ||
|
IDLH (Acil tehlike)
|
ND | ||
| Bağıntılı bileşikler | |||
|
Diğer anyonlar
|
Alüminyum florür Alüminyum bromür Alüminyum iyodür |
||
|
Diğer katyonlar
|
Bor triklorür Galyum triklorür İndiyum(III) klorür Magnezyum klorür |
||
|
İlgili Lewis asitleri
|
Demir(III) klorür Bor triflorür |
||
| Ek veri sayfası | |||
|
Kırılma indisi ( n ), Dielektrik sabiti (ε r ), vb. |
|||
|
termodinamik
veriler |
Faz davranışı katı-sıvı-gaz |
||
| UV , IR , NMR , MS | |||
|
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da). |
|||
|
|
|||
| Bilgi kutusu referansları | |||
Bölümler halinde alüminyum klorid (AlCb 3 olarak da bilinir), alüminyum triklorür , formüle sahip bileşikleri tanımlamaktadır AICI 3 (H 2 O) n (n = 0 ya da 6). 1:3 oranında alüminyum ve klor atomlarından oluşurlar ve bir form ayrıca altı hidrasyon suyu içerir . Her ikisi de beyaz katılardır, ancak numuneler genellikle sarı bir renk veren demir(III) klorür ile kirlenir .
Susuz malzeme ticari olarak önemlidir. Düşük bir erime ve kaynama noktasına sahiptir. Ağırlıklı olarak alüminyum metal üretiminde üretilip tüketilse de kimya sanayinin diğer alanlarında da büyük miktarlarda kullanılmaktadır. Bileşik genellikle bir Lewis asidi olarak belirtilir . Hafif sıcaklıkta bir polimerden bir monomere tersinir olarak değişen inorganik bir bileşiğe bir örnektir .
kullanır
Arenlerin alkilasyonu ve asilasyonu
AICI 3 ortak bir Lewis asidi olan bir katalizör için Friedel-Crafts reaksiyonları , hem açillemeler ve alkilasyonlar. Önemli ürünler deterjanlar ve etilbenzendir . Bu tür reaksiyonlar, örneğin benzen ve fosgenden antrakinonun ( boya maddeleri endüstrisinde kullanılan) hazırlanmasında, alüminyum klorürün başlıca kullanımıdır . Genel Friedel-Crafts reaksiyonunda, bir asil klorür veya alkil halojenür , gösterildiği gibi bir aromatik sistemle reaksiyona girer :
Alkilasyon reaksiyonu daha yaygın olarak daha kullanılan asilasyon kendi uygulama teknik açıdan daha talep olmasına karşın, reaksiyon. Her iki reaksiyon için de alüminyum klorürün yanı sıra diğer malzemeler ve ekipman, reaksiyonun devam etmesi için bir miktar nem gerekli olmasına rağmen kuru olmalıdır. Arenlerin alkilasyonu ve asilasyonu için ayrıntılı prosedürler mevcuttur.
Friedel-Crafts reaksiyonu ile ilgili genel bir problem, alüminyum klorür katalizörünün bazen tam stokiyometrik miktarlarda gerekli olmasıdır , çünkü ürünlerle kuvvetli bir şekilde kompleks oluşturur . Bu komplikasyon bazen büyük miktarda aşındırıcı atık üretir . Bu ve benzeri nedenlerle, alüminyum klorür kullanımının yerini genellikle zeolitler almıştır .
Alüminyum klorür, örneğin karbon monoksit , hidrojen klorür ve bir bakır(I) klorür yardımcı katalizörü kullanan Gattermann-Koch reaksiyonu yoluyla, aromatik halkalara aldehit gruplarını eklemek için de kullanılabilir .
Organik ve organometalik sentezdeki diğer uygulamalar
Alüminyum klorür, organik kimyada çok çeşitli başka uygulamalar bulur . Örneğin, "katalize edebilir en reaksiyonu gibi ilave olarak," 3-büten-2-on için (metil vinil keton) karvon :
Çeşitli hidrokarbon bağlantılarını ve yeniden düzenlemelerini indüklemek için kullanılır.
Bir arenin varlığında alüminyum ile birleştirilen alüminyum klorür, bis(aren) metal komplekslerini, örneğin bis(benzen) krom'u , Fischer - Hafner sentezi olarak adlandırılan yoluyla belirli metal halojenürlerden sentezlemek için kullanılabilir. Diklorofenilfosfin , alüminyum klorür ile katalize edilen benzen ve fosfor triklorürün reaksiyonuyla hazırlanır .
Yapı
Susuz
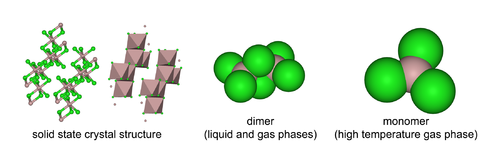
AlCl 3 , sıcaklığa ve duruma (katı, sıvı, gaz) bağlı olarak üç yapıyı benimser . Katı AlCl 3 , tabaka benzeri katmanlı kübik yakın paketlenmiş bir katmandır. Bu çerçevede, Al merkezleri oktahedral koordinasyon geometrisi sergiler . İtriyum(III) klorür , bir dizi başka bileşikle aynı yapıyı benimser. Alüminyum triklorür erimiş halde olduğu zaman, bu olarak var dimeri Al 2 Cl 6 ile, tetracoordinate alüminyum. Yapısındaki bu değişiklik, sıvı fazın daha düşük yoğunluğu ile (1.78 g / cm ' 3 ) katı alüminyum triklorür (2.48 g / cm' karşı 3 ). Al 2 Cı 6 dimerleri bulunan buhar fazı . Daha yüksek sıcaklıklarda, Al 2 Cı 6 dimerler ayırmak içine köşeli düzlemsel ALCL 3 için yapısal olarak benzer olan, BF 3 . Erime davranışlarda elektrik daha fazla- farklı olarak, zayıf iyonik halojenürler gibi sodyum klorür .
Alüminyum klorür monomer noktası D grubu ait 3 saat monomerik formunda ve D, 2 saat de dimerik formda.
hekzahidrat
Heksahidrat, oktahedral [Al(H 2 O) 6 ] 3+ merkezlerinden ve klorür karşı iyonlarından oluşur . Hidrojen bağları katyon ve anyonları birbirine bağlar . Alüminyum klorürün hidratlı formu, merkezi alüminyum iyonunun altı su ligand molekülü ile çevrili olduğu bir oktahedral moleküler geometriye sahiptir . Koordinatif doymuştur, hidrat olarak çok az bir değer olan bir katalizör olarak , Friedel-Crafts alkilasyonu ve ilgili reaksiyonların.
Reaksiyonlar
Susuz alüminyum klorür, benzofenon ve mesitilen gibi zayıf Lewis bazları ile bile Lewis asit-baz eklentileri oluşturabilen güçlü bir Lewis asididir . Bu oluşturan tetrakloroalüminat (AICI 4 - varlığında) klorür iyonları.
Alüminyum klorür , tetrahidrofuranda kalsiyum ve magnezyum hidritlerle reaksiyona girerek tetrahidroalüminatlar oluşturur.
Su ile reaksiyonlar
Susuz alüminyum klorür higroskopiktir ve su için çok belirgin bir afiniteye sahiptir. Nemli havada duman çıkar ve Cl - ligandları heksahidrat [Al(H 2 O) 6 ]Cl 3 oluşturmak üzere H 2 O molekülleri ile yer değiştirirken sıvı su ile karıştırıldığında tıslar . Susuz faz, hekzahidratın ısıtılmasıyla geri kazanılamaz. Bunun yerine HC1, alüminyum hidroksit veya alümina (alüminyum oksit) bırakarak kaybolur:
- Al(H 2 O) 6 Cl 3 → Al(OH) 3 + 3 HCl + 3 H 2 O
Gibi metal Akuo kompleksleri , sulu AICI 3 iyonizasyonu asidik dolayıdır aquo ligandları :
- [Al(H 2 O) 6 ] 3+ ⇌ [Al(OH)(H 2 O) 5 ] 2+ + H +
Sulu çözeltiler , hidratlı Al 3+ iyonları içeren diğer alüminyum tuzlarına benzer şekilde davranır ve seyreltik sodyum hidroksit ile reaksiyona girdiğinde jelatinli bir alüminyum hidroksit çökeltisi verir :
- AlCl 3 + 3 NaOH → [Al(OH) 3 ] + 3 NaCl
sentez
Alüminyum klorür, alüminyum metalin klor veya hidrojen klorür ile 650 ila 750 °C (1.202 ila 1.382 °F) arasındaki sıcaklıklarda ekzotermik reaksiyonuyla büyük ölçekte üretilir .
- 2 Al + 3 Cl 2 → 2 AlCl 3
- 2 Al + 6 HCl → 2 AlCl 3 + 3 H 2
Alüminyum klorür, bakır klorür ve alüminyum metal arasındaki tek bir yer değiştirme reaksiyonu yoluyla oluşturulabilir .
- 2 Al + 3 CuCl 2 → 2 AlCl 3 + 3 Cu
ABD'de 1993 yılında, alüminyum üretiminde tüketilen miktarları saymazsak, yaklaşık 21.000 ton üretilmiştir.
Hidratlı alüminyum triklorür, alüminyum oksitlerin hidroklorik asit içinde çözülmesiyle hazırlanır . Metalik alüminyum ayrıca hidroklorik asitte kolayca çözülür - hidrojen gazı açığa çıkarır ve önemli miktarda ısı üretir. Bu katının ısıtılması susuz alüminyum triklorür üretmez, heksahidrat ısıtıldığında alüminyum hidroksite ayrışır :
- Al(H 2 O) 6 Cl 3 → Al(OH) 3 + 3 HCl + 3 H 2 O
Alüminyum ayrıca daha düşük bir klorür , alüminyum(I) klorür (AlCl) oluşturur, ancak bu çok kararsızdır ve yalnızca buhar fazında bilinir.
Doğal oluşum
Susuz bileşik artık mineraller arasında bilinmiyor. Ancak heksahidrat, nadir mineral kloralüminit olarak bilinir. Daha karmaşık, bazik ve hidratlı bir mineral kadwaladerittir .
Emniyet
Susuz AICI 3 reaksiyona girer kuvvetli olan bazlar , bu nedenle uygun önlemler gerekmektedir. Solunması veya teması halinde gözlerde, ciltte ve solunum sisteminde tahrişe neden olabilir.
Ayrıca bakınız
Referanslar
Dış bağlantılar
- Uluslararası Kimyasal Güvenlik Kartı 1125
- AlCl 3 kullanan Organik Sentez prosedürlerinin indeksi
- 3 klorür periyodu
- MSDS
- Kanada Hükümeti Bilgi Formları ve Sıkça Sorulan Sorular: Alüminyum Tuzları