Sıcaklık - Temperature
| Sıcaklık | |
|---|---|
 Santigrat ve Fahrenhayt cinsinden sıcaklığı gösteren iki termometre.
| |
Ortak semboller |
T |
| SI birimi | K |
Diğer birimler |
°C , °F , °R , °Rø , °Ré , °N , °D , °L , °W |
| Yoğun mu? | Evet |
Diğer miktarlardan türevler |
, |
| Boyut | Θ |
| Termodinamik |
|---|

|
Sıcaklık ( / t ɛ m p ə r ə t ʃ ə r / tem başına ah-cher ) olduğunu ifade eder, sıcak ve soğuk fiziksel miktardır. Bir vücut daha soğuk veya daha sıcak olan başka bir cisimle temas ettiğinde , ısı oluşumunun , bir enerji akışının kaynağı olan, tüm maddelerde bulunan termal enerjinin tezahürüdür .
Sıcaklık bir termometre ile ölçülür . Termometreler, tarihsel olarak tanımlama için çeşitli referans noktaları ve termometrik maddeler kullanan çeşitli sıcaklık ölçeklerinde kalibre edilir . En yaygın ölçekler, Celsius ölçeği (önceden santigrat olarak adlandırılır, °C olarak gösterilir), Fahrenheit ölçeği (°F olarak gösterilir) ve Kelvin ölçeğidir (K olarak gösterilir), bunlardan sonuncusu ağırlıklı olarak bilimsel amaçlar için kullanılır. Uluslararası Birimler Sistemi (SI) sözleşmeleri .
En düşük teorik sıcaklık, bir vücuttan daha fazla termal enerjinin çekilemeyeceği mutlak sıfırdır . Deneysel olarak, sadece çok yakından (100 pK) yaklaşılabilir, ancak termodinamiğin üçüncü yasasında tanınan ulaşılamaz .
Sıcaklık, fizik , kimya , yer bilimi , astronomi , tıp , biyoloji , ekoloji , malzeme bilimi , metalurji , makine mühendisliği ve coğrafya dahil olmak üzere doğa bilimlerinin tüm alanlarında ve ayrıca günlük yaşamın birçok alanında önemlidir .
Etkileri
Birçok fiziksel süreç sıcaklıkla ilgilidir, bazıları aşağıda verilmiştir:
- faz ( katı , sıvı , gaz veya plazma ), yoğunluk , çözünürlük , buhar basıncı , elektriksel iletkenlik , sertlik , aşınma direnci , termal iletkenlik , korozyon direnci , mukavemet dahil olmak üzere malzemelerin fiziksel özellikleri
- kimyasal reaksiyonların meydana gelme hızı ve kapsamı
- bir nesnenin yüzeyinden yayılan termal radyasyonun miktarı ve özellikleri
- hava sıcaklığı tüm canlıları etkiler
- ses hızı mutlak sıcaklığın kare kökünün bir fonksiyonudur.
ölçekler
Sıcaklık ölçekleri iki şekilde farklılık gösterir: sıfır derece olarak seçilen nokta ve ölçekte artan birimlerin veya derecelerin büyüklükleri.
Yaygın olarak kullanılan teraziler
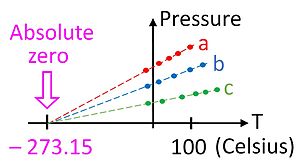
Santigrat ölçeği (° C) dünyanın en yaygın Sıcaklık ölçümleri için kullanılır. Tarihsel ilerlemeyle geliştirilen ve sıfır noktasına ulaşmasına neden olan ampirik bir ölçektir.0 °C , suyun donma noktası ile tanımlanır ve ek dereceler,100 °C , her ikisi de deniz seviyesindeki atmosfer basıncında suyun kaynama noktasıydı . 100 derecelik aralık nedeniyle, santigrat ölçeği olarak adlandırıldı. Kelvin'in Uluslararası Birimler Sisteminde standardizasyonundan bu yana, daha sonra Kelvin ölçeğindeki eşdeğer sabitleme noktaları açısından yeniden tanımlanmıştır ve böylece bir santigrat derecelik bir sıcaklık artışı, bir kelvinlik bir artışla aynı olur, yaklaşık olarak 273.15'lik bir ek kayma ile farklılık gösterirler.
Amerika Birleşik Devletleri yaygın olarak suyun donduğu Fahrenheit ölçeğini kullanır .32 ° F ve kaynarDeniz seviyesindeki atmosfer basıncında 212 °F .
Tamamen sıfır
En mutlak sıfır sıcaklığının, hiç bir enerji, ısı, eksprese edilen bir gerçek olarak madde çıkarılabilir Termodinamiğin üçüncü hakları . Bu sıcaklıkta madde makroskopik termal enerji içermez, ancak belirsizlik ilkesinin öngördüğü gibi kuantum-mekanik sıfır noktası enerjisine sahiptir , ancak bu mutlak sıcaklık tanımına girmez. Deneysel olarak, mutlak sıfıra ancak çok yakından yaklaşılabilir; asla ulaşılamaz (deney ile ulaşılan en düşük sıcaklık 100 pK'dır). Teorik olarak, mutlak sıfır sıcaklıktaki bir cisimde, parçacıklarının tüm klasik hareketi durmuştur ve bu klasik anlamda tam hareketsizdirler. Mutlak sıfır olarak tanımlanan0 K , yaklaşık olarak eşittir-273,15 °C veya-459.67 °F .
Mutlak ölçekler
Atfen Boltzmann sabiti için, Maxwell-Boltzmann dağılımı ve Boltzmann için istatistiki mekanik tanımlama ve entropi bağımsız bir şekilde, uluslararası anlaşmayla arası potansiyel enerji, göz ardı mikroskobik parçacıklar hareket ettirmek için Gibbs tanımından farklı olarak, bir sıcaklık ölçeği tanımlanır ve belirli termometrik maddelerin ve termometre mekanizmalarının özelliklerinden bağımsız olduğu için mutlak olduğu söylenir. Mutlak sıfır dışında bir referans sıcaklığı yoktur. Bilim ve teknolojide yaygın olarak kullanılan Kelvin ölçeği olarak bilinir . Kelvin (kelime küçük harf k ile yazılmıştır ), Uluslararası Birimler Sistemindeki (SI) sıcaklık birimidir . Kendi termodinamik denge durumundaki bir cismin sıcaklığı, mutlak sıfıra göre her zaman pozitiftir .
Uluslararası düzeyde kabul Kelvin ölçeğinde yanı sıra, aynı zamanda bir olduğu termodinamik sıcaklık ölçeği tarafından icat, Lord Kelvin sıcaklıkta mutlak sıfırda da sayısal sıfır, fakat, doğrudan saf makroskopik ilişkin termodinamik makroskopik de dahil olmak üzere, kavramlar entropi olsa mikroskobik gönderilebilir, Kanonik topluluk için Gibbs istatistiksel mekanik entropi tanımı, parçacıklar arası potansiyel enerjiyi ve ayrıca mutlak sıfıra yakın sıcaklıkların ölçümlerini hesaba katabilmesi için bağımsız parçacık hareketini hesaba katar. Bu skala, suyun üçlü noktasında bir referans sıcaklığına sahiptir ve sayısal değeri, yukarıda bahsedilen uluslararası kabul görmüş Kelvin skalası kullanılarak yapılan ölçümlerle tanımlanır.
Uluslararası Kelvin ölçeği
Birçok bilimsel ölçüm, onu ilk tanımlayan fizikçinin onuruna verilen Kelvin sıcaklık ölçeğini (birim sembolü: K) kullanır . Bu mutlak bir ölçektir. Sayısal sıfır noktası,0 K , sıcaklığın mutlak sıfır noktasındadır . Mayıs 2019'dan beri, dereceleri parçacık kinetik teorisi ve istatistiksel mekanik ile tanımlanmıştır. Gelen Uluslararası Birim Sistemi (SI), kelvin büyüklüğü mikroskobik parçacıklarının ortalama kinetik enerjileri çeşitli deneysel ölçümler yoluyla tanımlanır. Değeri uluslararası sözleşme ile sabit olarak tanımlanan Boltzmann sabiti cinsinden sayısal olarak değerlendirilir .
İstatistiksel mekanik ve termodinamik sıcaklık ölçekleri
Mayıs 2019'dan bu yana, kelvin'in büyüklüğü, istatistiksel mekanik açısından karakterize edilen mikroskobik olaylarla ilişkili olarak tanımlanmaktadır. Daha önce, 1954'ten beri, Uluslararası Birimler Sistemi , suyun üçlü noktasının güvenilir bir şekilde tekrarlanabilir sıcaklığını ikinci bir referans noktası olarak kullanarak, kelvin için bir termodinamik sıcaklık olarak bir ölçek ve birim tanımladı ; ilk referans noktasıMutlak sıfırda 0 K.
Tarihsel olarak, suyun üçlü nokta sıcaklığı, ölçüm artışının tam olarak 273.16 birimi olarak tanımlandı. Bugün ampirik olarak ölçülen bir miktardır. Deniz seviyesindeki atmosfer basıncında suyun donma noktası yaklaşık olarak273.15 Bin =0 °C .
Ölçeklerin sınıflandırılması
Çok çeşitli sıcaklık ölçeği vardır. Bunları ampirik ve teorik temelli olarak sınıflandırmak uygun olabilir. Ampirik sıcaklık ölçekleri tarihsel olarak daha eskiyken, teorik temelli ölçekler on dokuzuncu yüzyılın ortalarında ortaya çıktı.
ampirik ölçekler
Ampirik tabanlı sıcaklık ölçekleri, doğrudan malzemelerin basit makroskopik fiziksel özelliklerinin ölçümlerine dayanır. Örneğin, cam duvarlı bir kılcal boru içine hapsedilmiş bir cıva sütununun uzunluğu, büyük ölçüde sıcaklığa bağlıdır ve çok kullanışlı cam içinde cıva termometresinin temelidir. Bu tür ölçekler yalnızca uygun sıcaklık aralıklarında geçerlidir. Örneğin, cıvanın kaynama noktasının üzerinde, cam içinde cıva termometresi pratik değildir. Çoğu malzeme sıcaklık artışıyla genişler, ancak su gibi bazı malzemeler belirli bir aralıkta sıcaklık artışıyla büzülür ve daha sonra termometrik malzemeler olarak pek kullanışlı olmazlar. Bir malzeme, örneğin kaynama noktası gibi faz değişim sıcaklıklarından birinin yakınında termometre olarak kullanılmaz.
Bu sınırlamalara rağmen, en genel olarak kullanılan pratik termometreler ampirik temelli türdendir. Özellikle termodinamiğin keşfine büyük katkı sağlayan kalorimetri için kullanılmıştır . Bununla birlikte, teorik fizik için bir temel olarak değerlendirildiğinde ampirik termometrinin ciddi dezavantajları vardır. Ampirik tabanlı termometreler, termometrik malzemelerin sıradan fiziksel özelliklerinin basit doğrudan ölçümleri olarak temellerinin ötesinde, teorik fiziksel akıl yürütme kullanılarak yeniden kalibre edilebilir ve bu onların yeterlilik aralıklarını genişletebilir.
teorik ölçekler
Teorik temelli sıcaklık ölçekleri, özellikle kinetik teori ve termodinamik olmak üzere doğrudan teorik argümanlara dayanır. Pratik olarak uygulanabilir fiziksel cihaz ve malzemelerde aşağı yukarı ideal olarak gerçekleştirilmektedirler. Teorik temelli sıcaklık ölçekleri, pratik ampirik temelli termometreler için kalibrasyon standartları sağlamak için kullanılır.
Mikroskobik istatistiksel mekanik ölçek
Fizikte, uluslararası kabul görmüş geleneksel sıcaklık ölçeğine Kelvin ölçeği denir. Sıcaklığı ölçülecek olan vücuttaki atomlar, moleküller ve elektronlar gibi mikroskobik parçacıkların hareketlerine atıfta bulunarak, Boltzmann sabitinin uluslararası kabul görmüş ve öngörülen değeri aracılığıyla kalibre edilir. Kelvin tarafından icat edilen termodinamik sıcaklık ölçeğinin aksine, şu anda geleneksel olan Kelvin sıcaklığı, standart bir cismin referans durumunun sıcaklığıyla veya makroskopik termodinamik açısından karşılaştırılarak tanımlanmaz.
Mutlak sıcaklık sıfırından ayrı olarak, bir iç termodinamik denge durumundaki bir cismin Kelvin sıcaklığı, Boltzmann sabiti cinsinden kesin olarak bilinen teorik açıklamalar gibi, fiziksel özelliklerinden uygun şekilde seçilen ölçümlerle tanımlanır . Bu sabit, vücudun yapısındaki mikroskobik parçacıkların seçilmiş hareket türlerini ifade eder. Bu tür hareketlerde, parçacıklar karşılıklı etkileşim olmaksızın ayrı ayrı hareket eder. Bu tür hareketler tipik olarak parçacıklar arası çarpışmalarla kesintiye uğrar, ancak sıcaklık ölçümü için hareketler, çarpışmalar arasında yörüngelerinin etkileşimli olmayan bölümlerinin doğru ölçüm için erişilebilir olduğu bilinecek şekilde seçilir. Bu amaçla, parçacıklar arası potansiyel enerji dikkate alınmaz.
Bir in İdeal gaz ve diğer teorik anlaşılacaktır gövdelerinde, Kelvin sıcaklık uygun bir teknik ile ölçülebilir etkileşimsiz hareket mikroskobik parçacıklarının ortalama kinetik enerji, orantılı olarak tanımlanır. Orantılılık sabiti, Boltzmann sabitinin basit bir katıdır. Molekül, atom, ya da elektronların, malzeme yayılan ve hızları ölçülür, bunların hızlarının spektrumu genellikle yaklaşık olarak adlandırılan bir teorik yasa uyar Maxwell-Boltzmann dağılım yasası sahip olduğu ve sıcaklıkların iyi kurulmuş bir ölçümünü verir, . Termometri için doğrudan Fermi-Dirac dağılımını kullanan aynı türden başarılı deneyler henüz yapılmamıştır , ancak belki de bu gelecekte başarılacaktır.
Bir gazdaki sesin hızı, teorik olarak gazın moleküler karakterinden, sıcaklığından ve basıncından ve Boltzmann sabitinin değerinden hesaplanabilir. Bilinen moleküler karaktere ve basınca sahip bir gaz için bu, sıcaklık ile Boltzmann sabiti arasında bir ilişki sağlar. Bu miktarlar, bir su numunesinin üçlü noktasındaki durumunu tanımlayan termodinamik değişkenlerden daha kesin olarak bilinebilir veya ölçülebilir. Sonuç olarak, Boltzmann sabitinin değeri, tam olarak tanımlanmış bir değerin birincil olarak tanımlanmış referansı olarak alındığında, ses hızının bir ölçümü, gazın sıcaklığının daha kesin bir ölçümünü sağlayabilir.
İdeal bir üç boyutlu siyah cisimden elektromanyetik radyasyon spektrumunun ölçümü, doğru bir sıcaklık ölçümü sağlayabilir, çünkü siyah cisim radyasyonunun maksimum spektral ışıma frekansı, kara cismin sıcaklığı ile doğru orantılıdır; bu Wien'in yer değiştirme yasası olarak bilinir ve Planck yasasında ve Bose-Einstein yasasında teorik bir açıklaması vardır .
Bir elektrik direnci tarafından üretilen gürültü-güç spektrumunun ölçümü de doğru sıcaklık ölçümü sağlayabilir. Direncin iki terminali vardır ve aslında tek boyutlu bir gövdedir. Bu durum için Bose-Einstein yasası, gürültü gücünün direncin sıcaklığı ve direncinin değeri ve gürültü bant genişliği ile doğru orantılı olduğunu gösterir. Belirli bir frekans bandında, gürültü-gücü her frekanstan eşit katkılara sahiptir ve Johnson gürültüsü olarak adlandırılır . Direncin değeri biliniyorsa, sıcaklık bulunabilir.
Makroskopik termodinamik ölçek
Tarihsel olarak, Mayıs 2019'a kadar, Kelvin ölçeğinin tanımı, ideal bir Carnot motorundaki süreçlerdeki enerji miktarlarının oranına, tamamen makroskopik termodinamik açısından Kelvin tarafından icat edildi. Bu Carnot motoru, sıcaklığı ölçülecek olan cisminki ile suyun üçlü noktası sıcaklığındaki bir cismin referansı olan iki sıcaklık arasında çalışacaktı. Daha sonra, üçlü noktanın referans sıcaklığı tam olarak tanımlandı.273,16 K . Mayıs 2019'dan bu yana, bu değer tanım gereği sabitlenmemiştir, ancak yukarıda açıklandığı gibi Boltzmann sabitini içeren mikroskobik fenomenlerle ölçülmelidir. Mikroskobik istatistiksel mekanik tanımın bir referans sıcaklığı yoktur.
Ideal gaz
Makroskopik olarak tanımlanmış bir sıcaklık ölçeğinin temel alınabileceği bir malzeme ideal gazdır . İdeal bir gazın sabit bir hacmi ve kütlesi tarafından uygulanan basınç, sıcaklığı ile doğru orantılıdır. Bazı doğal gazlar, uygun sıcaklık aralığında o kadar ideale yakın özellikler gösterirler ki, termometri için kullanılabilirler; bu termodinamiğin gelişimi sırasında önemliydi ve bugün hala pratik önemi var. Ancak ideal gaz termometresi, termodinamik için teorik olarak mükemmel değildir. Bunun nedeni, ideal bir gazın mutlak sıfır sıcaklığındaki entropisinin, gazı termodinamiğin üçüncü yasasını ihlal eden pozitif yarı belirli bir miktar olmamasıdır. Gerçek malzemelerin aksine, ideal gaz ne kadar soğuk olursa olsun sıvılaşmaz veya katılaşmaz. Alternatif olarak, ideal gaz yasası, sonsuz yüksek sıcaklık ve sıfır basınç sınırına atıfta bulunur; bu koşullar, kurucu moleküllerin etkileşimli olmayan hareketlerini garanti eder.
Kinetik teori yaklaşımı
Kelvin'in büyüklüğü şimdi, Boltzmann sabitinin değerinden türetilen kinetik teori açısından tanımlanmaktadır .
Kinetik teori , makroskopik sistemlerin çeşitli türlerin molekülleri ve iyonları gibi birçok mikroskobik parçacıktan oluşmasına ve bir türün parçacıklarının hepsi birbirine benzer olmasına dayalı olarak, bazı malzeme gövdeleri, özellikle gazlar için mikroskobik bir sıcaklık hesabı sağlar . Makroskopik olayları , mikroskobik parçacıkların klasik mekaniği aracılığıyla açıklar . Eşbölüşüm teoremi kinetik teorinin her klasik iddia serbestlik derecesi serbestçe hareket eden bir parçacığın ortalama kinetik enerjiye sahiptir k B , T / 2 K B belirtmektedir Boltzmann sabiti . Parçacığın translasyon hareketi kuantum etkisi, ısı ile bir sistemde serbestçe hareket eden bir parçacığın ortalama öteleme kinetik enerji baskın çok düşük sıcaklıklarda dışında, böylece üç serbestlik derecesine sahiptir T olacak 3 k B , T / 2 .
Oksijen (O 2 ) gibi moleküller , tek küresel atomlardan daha fazla serbestlik derecesine sahiptir : dönme ve titreşim hareketlerinin yanı sıra ötelemelere de maruz kalırlar. Isıtma, moleküllerin ortalama translasyon kinetik enerjisindeki bir artıştan dolayı sıcaklığın artmasına neden olur. Isıtma aynı zamanda, eşit bölümleme yoluyla , titreşim ve dönme modları ile ilişkili enerjinin artmasına neden olacaktır. Böylece iki atomlu bir gaz, sıcaklığını belirli bir miktar artırmak için daha fazla enerji girdisi gerektirecektir, yani tek atomlu bir gazdan daha büyük bir ısı kapasitesine sahip olacaktır .
Yukarıda belirtildiği gibi, bir gazdaki sesin hızı, gazın moleküler karakterinden, sıcaklığından ve basıncından ve Boltzmann sabitinin değerinden hesaplanabilir. Boltzmann sabitinin değeri, tam olarak tanımlanmış değerin birincil olarak tanımlanmış referansı olarak alındığında, ses hızının ölçümü, gazın sıcaklığının daha kesin bir ölçümünü sağlayabilir.
Sistemin kütlesinden, muhafaza duvarındaki küçük bir delikten kaçmalarına izin verilirse, oluşturan mikroskobik parçacıkların ortalama kinetik enerjisini ölçmek mümkündür. Hızların spektrumu ölçülmeli ve bundan ortalama hesaplanmalıdır. Kaçan ve ölçülen parçacıkların, sistemin kütlesinde kalan parçacıklarla aynı hız dağılımına sahip olması zorunlu değildir, ancak bazen iyi bir numune alınması mümkündür.
termodinamik yaklaşım
Sıcaklık, termodinamik çalışmasında temel niceliklerden biridir . Önceleri kelvin büyüklüğü termodinamik terimlerle tanımlanırken, günümüzde yukarıda bahsedildiği gibi kinetik teori ile tanımlanmaktadır.
Termodinamik sıcaklığın iki nedenden dolayı mutlak olduğu söylenir . Birincisi, biçimsel karakterinin belirli malzemelerin özelliklerinden bağımsız olmasıdır. Diğer neden ise, sıfırın bir anlamda mutlak olmasıdır, çünkü maddenin kurucu parçacıklarının mikroskobik klasik hareketinin yokluğunu gösterir, böylece üçüncü yasaya göre sıfır sıcaklık için sıfır sıcaklık için sınırlayıcı bir özgül ısıya sahiptirler. termodinamik. Bununla birlikte, bir termodinamik sıcaklığın aslında gelenek tarafından keyfi olarak seçilen ve belirli malzemelerin özelliklerine bağlı olan belirli bir sayısal değeri vardır; Celsius ve Fahrenheit gibi göreceli "derece" ölçeklerinden daha az keyfidir . Bir sabit noktalı (sıfır) mutlak bir ölçek olduğundan, göreli ölçeklerde olduğu gibi ikiden ziyade keyfi seçime bırakılan yalnızca bir serbestlik derecesi vardır. Mayıs 2019'dan bu yana Kelvin ölçeği için, uluslararası sözleşmeyle, moleküler hareketle ilgili mikroskobik kinetik teorilere dayanarak, çeşitli termometrik cihazların çalışma modları bilgisini kullanmak için seçim yapıldı. Sayısal ölçek, makroskopik sıcaklığı moleküller gibi parçacıkların ortalama mikroskobik kinetik enerjisiyle ilişkilendiren Boltzmann sabitinin değerinin geleneksel bir tanımıyla belirlenir . Sayısal değeri isteğe bağlıdır ve Kelvin'in Celsius ile olduğu gibi Fahrenheit ölçeğiyle hizalanmak üzere yapılan Rankine ölçeği adı verilen alternatif, daha az yaygın olarak kullanılan bir mutlak sıcaklık ölçeği vardır .
Sıcaklığın termodinamik tanımı Kelvin'den kaynaklanmaktadır. Carnot motoru adı verilen idealize edilmiş bir cihaz terimleriyle çerçevelenmiştir ve çalışma gövdesinin bir durum döngüsünü kateden ardışık süreçlerin kurgusal sürekli döngüsünde çalıştığı hayal edilmiştir . Motor, ısı bir miktarda alan Q 1 bir sıcak hazneden ve ısı daha az bir miktarda geçer Q 2 soğuk hazneye. Enerjideki fark, termodinamik iş olarak bir iş haznesine iletilir ve motorun çıktısı olarak kabul edilir. Döngünün o kadar yavaş çalıştığı tasavvur edilir ki, döngünün her noktasında çalışan vücut bir termodinamik denge durumundadır. Döngünün ardışık süreçlerinin bu nedenle entropi üretimi olmadan tersine çevrilebilir şekilde çalıştığı tasavvur edilir. O halde, çalışma gövdesi ısıtıldığında sıcak hazneden alınan entropi miktarı, çalışma gövdesi soğutulduğunda soğuk hazneye iletilen entropi miktarına eşittir. Daha sonra, mutlak veya termodinamik sıcaklık, T 1 ve T 2 o şekilde olması için çok rezervuarların tanımlandığı gibidir,
-
(1)
Termodinamiğin sıfırıncı yasası, diğer ısı rezervuarını ilgilenilen cisimle aynı sıcaklığa getirerek, bu tanımın keyfi bir ilgi cismi mutlak veya termodinamik sıcaklığını ölçmek için kullanılmasına izin verir.
Kelvin'in mutlak sıcaklığı öne süren orijinal çalışması 1848'de yayınlandı. Termodinamiğin birinci yasasının formülasyonundan önce Carnot'un çalışmasına dayanıyordu. Carnot, ısı konusunda sağlam bir anlayışa ve belirli bir entropi kavramına sahip değildi. 'Kalorik' yazdı ve sıcak rezervuardan geçen tüm kalorinin soğuk rezervuara geçtiğini söyledi. Kelvin, 1848 tarihli makalesinde, ölçeğinin "herhangi bir özel maddenin özelliklerinden bağımsız olarak" tanımlanması anlamında mutlak olduğunu yazdı. Az önce belirtilen tanımı ortaya koyan kesin yayını, 1851'de okunan bir makale olan 1853'te basıldı.
Sayısal ayrıntılar daha önce ısı depolarından birinin mutlak sıcaklığı 273,16 K olarak tanımlanan suyun üçlü noktasında hücre haline getirilmesiyle çözülüyordu. Günümüzde sayısal değer, mikroskobik istatistiksel mekanik uluslararası tanım yoluyla ölçümden elde ediliyor. , yukarıdaki gibi.
Yoğun değişkenlik
Termodinamik açıdan, sıcaklık bir olan yoğun bir değişken bir eşit olduğu için diferansiyel katsayısı biri geniş değişken belirli bir vücut için diğerine göre, ile. Bu nedenle var boyutları a oranında , iki geniş değişken. Termodinamikte, iki cismin genellikle bazı özel geçirgenlik özelliklerine sahip ortak bir duvarla temas yoluyla bağlı olduğu düşünülür. Bu tür özel geçirgenlik, belirli bir yoğun değişkene atıfta bulunulabilir. Bir örnek, yalnızca ısıya karşı geçirgen olan diyatermik bir duvardır; bu durum için yoğun değişken sıcaklıktır. İki cisim çok uzun bir süre boyunca özel olarak geçirgen duvar yoluyla bağlandığında ve kalıcı bir kararlı duruma yerleştiğinde, ilgili yoğun değişkenler iki cisimde eşittir; bir diyatermal duvar için, bu ifade bazen termodinamiğin sıfırıncı yasası olarak adlandırılır.
Vücudun belirten ile tarif edildiğinde, özellikle iç enerji u onun bir fonksiyonu olarak, geniş bir değişken, entropi S , aynı zamanda geniş bir değişken ve diğer durum değişkenleri V , N ile birlikte, U = U ( S , V , N, ), o zaman sıcaklık, iç enerjinin entropiye göre kısmi türevine eşittir :
-
(2)
Benzer şekilde, vücut entropisini S kendi iç enerjisinin bir fonksiyonu olarak U , ve diğer durum değişkenleri V , N , S = S ( U , V , N ) olarak belirterek tanımlandığında , sıcaklığın tersi eşittir entropinin iç enerjiye göre kısmi türevi:
-
(3)
Mutlak sıcaklığın yukarıdaki tanımı, denklem (1), Kelvin'den kaynaklanmaktadır. Madde transferine kapalı sistemlere atıfta bulunur ve doğrudan deneysel prosedürlere özel bir vurgu yapar. Gibbs tarafından termodinamiğin sunumu daha soyut bir düzeyde başlar ve maddenin transferine açık sistemlerle ilgilenir; termodinamiğin bu gelişiminde, yukarıdaki (2) ve (3) denklemleri aslında sıcaklığın alternatif tanımlarıdır.
Yerel termodinamik denge
Gerçek dünya cisimleri genellikle termodinamik dengede değildir ve homojen değildir. Klasik tersinmez termodinamik yöntemleriyle yapılan çalışma için, bir cisim genellikle uzamsal ve zamansal olarak kavramsal olarak küçük boyutlu 'hücrelere' bölünür. Böyle bir 'hücre'de madde için klasik termodinamik denge koşulları iyi bir yaklaşımla sağlanırsa, o zaman homojendir ve onun için bir sıcaklık vardır. Bu, vücudun her 'hücresi' için böyleyse, vücutta yerel termodinamik dengenin hüküm sürdüğü söylenir.
Örneğin, geniş kapsamlı U değişkeni veya kapsamlı S değişkeni için, sistemin birim hacim başına bir yoğunluğuna veya sistemin birim kütlesi başına bir miktara sahip olduğunu söylemek mantıklıdır, ancak bundan bahsetmenin bir anlamı yoktur. birim hacim başına sıcaklık yoğunluğu veya sistemin birim kütlesi başına sıcaklık miktarı. Öte yandan, bir noktadaki iç enerjiden bahsetmek anlamsızken, yerel termodinamik denge hakim olduğunda, bir noktadaki sıcaklıktan bahsetmek mantıklıdır. Sonuç olarak, sıcaklık, küresel termodinamik dengede olmayan, ancak yerel termodinamik dengenin olduğu bir ortamda noktadan noktaya değişebilir.
Bu nedenle, bir cisimde yerel termodinamik denge hakim olduğunda, sıcaklık o cisimde uzaysal olarak değişen yerel bir özellik olarak kabul edilebilir ve bunun nedeni sıcaklığın yoğun bir değişken olmasıdır.
temel teori
|
Termodinamiğin eşlenik değişkenleri |
|
|---|---|
| Baskı yapmak | Ses |
| ( stres ) | ( gerinim ) |
| Sıcaklık | Entropi |
| Kimyasal potansiyel | parçacık numarası |
Sıcaklık, bir malzemenin durumunun kalitesinin bir ölçüsüdür . Kaliteli önlemlerinin o herhangi bir sıcaklık ölçeği buna daha soyut bir varlık olarak kabul edilebilir ve denir hotness bazı yazarlar tarafından. Sıcaklığın kalitesi, yalnızca belirli bir bölgedeki malzemenin durumunu ifade eder ve genel olarak, sabit bir termodinamik denge durumunda tutulan cisimler dışında, sıcaklık yerden yere değişir. Belirli bir yerdeki bir malzemenin, iyi tanımlanmış bir sıcaklığa veya sıcaklığa sahip olmasına izin verecek kadar sabit ve neredeyse homojen bir durumda olması zorunlu değildir. Sıcaklık soyut olarak tek boyutlu bir manifold olarak temsil edilebilir . Her geçerli sıcaklık ölçeğinin, sıcaklık manifolduna yönelik kendi bire bir haritası vardır.
Termal temas halindeki iki sistem aynı sıcaklıkta olduğunda aralarında ısı transferi olmaz. Bir sıcaklık farkı olduğunda, ısı, sıcak sistemden soğuk sisteme, termal dengeye gelinceye kadar kendiliğinden akar . Bu tür bir ısı transferi, iletim veya termal radyasyon yoluyla gerçekleşir.
Deneysel fizikçiler, örneğin Galileo ve Newton , sonsuz sayıda ampirik sıcaklık ölçeği olduğunu buldular . Bununla birlikte, termodinamiğin sıfırıncı yasası, hepsinin aynı kaliteyi ölçtüğünü söylüyor. Bu, kendi iç termodinamik denge durumundaki bir vücut için, vücudun sıcaklığını ölçen, doğru kalibre edilmiş her termometrenin, tek ve aynı sıcaklığı kaydettiği anlamına gelir. Kendi iç termodinamik denge durumunda olmayan bir cisim için, farklı termometreler, sırasıyla termometrelerin çalışma mekanizmalarına bağlı olarak farklı sıcaklıkları kaydedebilir.
Termodinamik dengedeki cisimler
Deneysel fizik için sıcaklık, verilen herhangi iki cismi kendi ayrı termodinamik dengelerinde karşılaştırırken , sayısal ölçek okumaları olan uygun şekilde verilen herhangi iki ampirik termometrenin, verilen iki cisimden hangisinin daha sıcak olduğu konusunda hemfikir olacağı veya aynı sıcaklık. Bu, iki termometrenin sayısal ölçek okumaları arasında doğrusal bir ilişkiye sahip olmasını gerektirmez, ancak sayısal okumaları arasındaki ilişkinin kesinlikle monoton olmasını gerektirir . Daha sıcaklık artışı ve kesin bir anlamda bağımsız olarak, bulunabilmektedir kalorimetrisi arasında, termodinamik gelen, ve özellikle malzemelerin özelliklerinin Wien hareket yasasına ait termal radyasyon : bir banyo sıcaklığı termal radyasyona olan orantılı için, evrensel bir sabit ile, frekans spektrumunun maksimum frekansı ; bu frekans her zaman pozitiftir, ancak sıfıra eğilimli değerlere sahip olabilir . Termal radyasyon başlangıçta termodinamik dengede bir boşluk için tanımlanır. Bu fiziksel gerçekler, sıralı bir tek boyutlu manifold üzerinde sıcaklığın var olduğuna dair matematiksel bir ifadeyi doğrular . Bu, kendi termodinamik dengelerindeki cisimler için sıcaklık ve termometrelerin temel bir karakteridir.
Buzun erimesi gibi birinci dereceden bir faz değişimine uğrayan bir sistem dışında , kapalı bir sistem ısı aldığından, hacminde ve üzerine etki eden dış kuvvet alanlarında bir değişiklik olmaksızın sıcaklığı yükselir. Termodinamik dengeden ayrılma ihmal edilebilecek kadar yavaş bir faz değişimi geçiren bir sistem için, sisteme gizli ısı verilirken sıcaklığı sabit kalır . Tersine, kapalı bir sistemden, faz değişikliği olmadan, hacim değişikliği olmadan ve üzerine etki eden dış kuvvet alanlarında bir değişiklik olmadan ısı kaybı, sıcaklığını düşürür.
Kararlı durumda olan ancak termodinamik dengede olmayan cisimler
Kendi termodinamik denge durumlarındaki cisimler için sıcaklık kavramı, tüm ampirik termometrelerin iki cisimden hangisinin daha sıcak olduğu veya aynı sıcaklıkta oldukları konusunda hemfikir olmasını gerektirirken, bu gereklilik sabit durumdaki cisimler için güvenli değildir. halleri termodinamik dengede olmasa da. O halde, farklı ampirik termometreler, hangisinin daha sıcak olduğu konusunda fikir ayrılığına düşebilir ve eğer öyleyse, cisimlerden en az birinin iyi tanımlanmış bir mutlak termodinamik sıcaklığı yoktur. Bununla birlikte, herkes bir beden vermiş ve uygun herhangi bir ampirik termometre, uygun bir süreç yelpazesi için ampirik, mutlak olmayan, sıcaklık ve sıcaklık kavramlarını hala destekleyebilir. Bu, denge dışı termodinamiğin incelenmesi için bir konudur .
Sabit durumda olmayan cisimler
Bir cisim kararlı durumda olmadığında, sıcaklık kavramı termodinamik dengede olmayan kararlı durumdaki bir cisme göre daha az güvenli hale gelir. Bu aynı zamanda denge dışı termodinamiğin incelenmesi için bir konudur .
Termodinamik denge aksiyomatiği
Termodinamik dengenin aksiyomatik tedavisi için, 1930'lardan beri, termodinamiğin sıfırıncı yasasına atıfta bulunmak geleneksel hale geldi . Böyle bir yasanın geleneksel olarak belirtilen minimalist versiyonu, yalnızca, termal olarak bağlı olduklarında termal dengede olacak olan tüm cisimlerin tanım gereği aynı sıcaklığa sahip olduklarının söylenmesi gerektiğini, ancak kendi başına sıcaklığı gerçek olarak ifade edilen bir nicelik olarak belirlemediğini varsayar. bir ölçekte numara. Böyle bir yasanın fiziksel olarak daha bilgilendirici bir versiyonu, ampirik sıcaklığı bir sıcaklık manifoldu üzerindeki bir çizelge olarak görür. Sıfırıncı yasa, birçok farklı ampirik sıcaklık ölçeğinin tanımına izin verirken, termodinamiğin ikinci yasası , termodinamik sıcaklık olarak adlandırılan keyfi bir ölçek faktörüne kadar benzersiz , tek bir tercih edilen, mutlak sıcaklık tanımını seçer . Eğer iç enerji termodinamik dengede Homojen bir sistemin hacmi ve entropi bir fonksiyonu olarak kabul edilir, termodinamik mutlak sıcaklık kısmi türevi olarak görünür iç enerji bakımından entropi sabit hacimde. Doğal, içsel orijini veya sıfır noktası, herhangi bir sistemin entropisinin minimum olduğu mutlak sıfırdır . Bu, model tarafından tanımlanan en düşük mutlak sıcaklık olmasına rağmen , termodinamiğin üçüncü yasası, mutlak sıfırın herhangi bir fiziksel sistem tarafından elde edilemeyeceğini varsayar.
Isı kapasitesi
Bir cisme veya cisimden enerji transferi sadece ısı olarak olduğunda, cismin durumu değişir. Çevreye ve onları vücuttan ayıran duvarlara bağlı olarak vücutta çeşitli değişiklikler mümkündür. Bunlar kimyasal reaksiyonlar, basınç artışı, sıcaklık artışı ve faz değişimini içerir. Belirli koşullar altında her tür değişim için ısı kapasitesi, aktarılan ısı miktarının değişimin büyüklüğüne oranıdır.
Örneğin, değişim, faz değişimi ve kimyasal değişim olmadan sabit hacimde sıcaklıkta bir artış ise, vücudun sıcaklığı yükselir ve basıncı artar. Aktarılan ısı miktarı, Δ Q , gözlemlenen sıcaklık değişimine bölünür, Δ T , vücudun sabit hacimdeki ısı kapasitesidir :
Isı kapasitesi, iyi tanımlanmış bir madde miktarı için ölçülürse , özgül ısı , böyle bir birim miktarın sıcaklığını bir birim sıcaklık artırmak için gereken ısının ölçüsüdür. Örneğin, suyun sıcaklığını bir kelvin (bir santigrat dereceye eşittir) yükseltmek, kilogram başına 4186 jul (J/kg) gerektirir.
Ölçüm
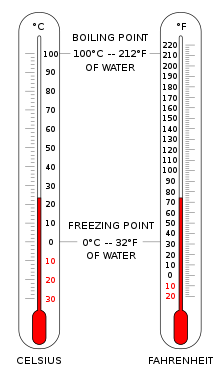
Modern bilimsel termometreler ve sıcaklık ölçekleri kullanılarak sıcaklık ölçümü , Gabriel Fahrenheit'in bir termometreyi ( cıvaya geçiş ) ve her ikisi de Ole Christensen Rømer tarafından geliştirilen bir ölçeği uyarladığı 18. yüzyılın başlarına kadar gider . Fahrenheit ölçeği, bilimsel olmayan uygulamalar için Amerika Birleşik Devletleri'nde hala kullanılmaktadır.
Sıcaklık, çeşitli sıcaklık ölçeklerine göre kalibre edilebilen termometrelerle ölçülür . Dünyanın çoğu yerinde ( Belize , Myanmar , Liberya ve Amerika Birleşik Devletleri hariç ), çoğu sıcaklık ölçümü amacı için Celsius ölçeği kullanılır. Çoğu bilim insanı sıcaklığı Celsius ölçeğini kullanarak ve termodinamik sıcaklığı , Celsius ölçeği ofseti olan Kelvin ölçeğini kullanarak ölçer , böylece sıfır noktası0 bin =−273.15 °C veya mutlak sıfır . ABD'deki birçok mühendislik alanı, özellikle yüksek teknoloji ve ABD federal spesifikasyonları (sivil ve askeri), Kelvin ve Celsius ölçeklerini de kullanır. ABD'deki diğer mühendislik alanları da yanma gibi termodinamik ile ilgili disiplinlerde çalışırken Rankine ölçeğine (değiştirilmiş bir Fahrenheit ölçeği) dayanır .
Birimler
Uluslararası Birimler Sistemindeki (SI) temel sıcaklık birimi Kelvin'dir . K sembolüne sahiptir.
Günlük uygulamalar için genellikle Celsius ölçeğini kullanmak uygundur. 0 °C , suyun donma noktasına çok yakındır ve100 °C , deniz seviyesindeki kaynama noktasıdır . Sıvı damlacıklar genellikle bulutlarda sıfırın altındaki sıcaklıklarda bulunduğundan,0 °C , buzun erime noktası olarak daha iyi tanımlanır. Bu ölçekte, 1 derece Celsius arasında bir sıcaklık farkı ile aynıdır 1 Kelvin artış ama ölçek sıcaklığında telafi edildiği buz erir (273.15K ).
: Uluslararası bir anlaşma ile, Mayıs 2019 yılına kadar Kelvin Celsius ölçekler iki sabitleme noktası tarafından tanımlanan mutlak sıfır ve üçlü nokta arasında Viyana standart ortalama Okyanus Su özel olarak hidrojen ve oksijen izotopları, belirtilen bir karışımı ile hazırlanmış su. Mutlak sıfır tam olarak şu şekilde tanımlandı:0 K ve-273,15 °C . Maddeyi oluşturan parçacıkların tüm klasik öteleme hareketinin durduğu ve klasik modelde tamamen hareketsiz oldukları sıcaklıktır. Kuantum-mekanik olarak, ancak, sıfır noktası hareketi kalır ve ilişkili bir enerjiye, sıfır noktası enerjisine sahiptir . Madde taban halindedir ve termal enerji içermez . sıcaklıklar273.16 Bin ve0.01 °C , suyun üçlü noktasınınkiler olarak tanımlandı. Bu tanım şu amaçlara hizmet etti: kelvin büyüklüğünü mutlak sıfır ile suyun üçlü noktası arasındaki farkın 273.16 parçasında tam olarak 1 parça olarak sabitledi; bir kelvin'in, Celsius ölçeğinde bir derece ile tam olarak aynı büyüklüğe sahip olduğunu tespit etti; ve bu ölçeklerin sıfır noktaları arasındaki farkı şu şekilde belirlemiştir:273,15 Bin (0 bin =-273,15 °C ve273.16 Bin =0.01 °C ). 2019'dan beri Boltzmann sabitine dayanan yeni bir tanım var, ancak ölçekler pek değiştirilmiyor.
Amerika Birleşik Devletleri'nde Fahrenheit ölçeği en yaygın kullanılanıdır. Bu ölçekte suyun donma noktası,32 ° F ve kaynama noktası212 °F . ABD'de kimya mühendisliği alanlarında halen kullanılan Rankine ölçeği, Fahrenheit artışına dayalı mutlak bir ölçektir.
Dönüştürmek
Aşağıdaki tablo, Santigrat ölçeğine ve Santigrat ölçeğinden dönüşümler için sıcaklık dönüşüm formüllerini gösterir .
| dan Celsius | Celsius'a | |
|---|---|---|
| Fahrenhayt | [°F] = [°C] × 9 ⁄ 5 + 32 | [°C] = ([°F] − 32) × 5 ⁄ 9 |
| Kelvin | [K] = [°C] + 273.15 | [°C] = [K] − 273.15 |
| Rankine | [°R] = ([°C] + 273.15) × 9 ⁄ 5 | [°C] = ([°R] − 491.67) × 5 ⁄ 9 |
| Delisle | [°De] = (100 − [°C]) × 3 ⁄ 2 | [°C] = 100 − [°De] × 2 ⁄ 3 |
| Newton | [°N] = [°C] × 33 ⁄ 100 | [°C] = [°N] × 100 ⁄ 33 |
| Réaumur | [°Ré] = [°C] × 4 ⁄ 5 | [°C] = [°Ré] × 5 ⁄ 4 |
| Romer | [°Rø] = [°C] × 21 ⁄ 40 + 7,5 | [°C] = ([°Rø] − 7,5) × 40 ⁄ 21 |
plazma fiziği
Plazma fiziği alanı, çok yüksek sıcaklıkları içeren elektromanyetik doğa olaylarıyla ilgilenir . Sıcaklığı elektronvolt (eV) veya kiloelektronvolt (keV) cinsinden enerji olarak ifade etmek gelenekseldir . Sıcaklıktan farklı bir boyutu olan enerji daha sonra Boltzmann sabiti ile sıcaklığın çarpımı olarak hesaplanır . Ardından, 1 eV şuna karşılık gelir: 11 605 K . Çalışmasında QCD madde bir rutin birkaç yüz civarında sıcaklıklar karşılaşır MeV yaklaşık eşdeğer10 12 K .
teorik temel
Tarihsel olarak, sıcaklığın açıklanmasına yönelik birkaç bilimsel yaklaşım vardır: bir laboratuvarda ölçülebilen makroskopik ampirik değişkenlere dayanan klasik termodinamik tanımlama; gazların kinetik teorisi gaz partiküllerinin hareket enerjisinin olasılık dağılımına makroskopik açıklama ile ilgilidir; ve istatistiksel fizik ve kuantum mekaniğine dayanan mikroskobik bir açıklama . Ek olarak, titiz ve tamamen matematiksel işlemler, klasik termodinamik ve sıcaklığa aksiyomatik bir yaklaşım sağlamıştır. İstatistiksel fizik, maddenin atomik davranışını tanımlayarak daha derin bir anlayış sağlar ve hem klasik hem de kuantum durumları dahil olmak üzere mikroskobik durumların istatistiksel ortalamalarından makroskopik özellikler türetir. Temel fiziksel tanımlamada, doğal birimler kullanılarak , sıcaklık doğrudan enerji birimlerinde ölçülebilir. Bununla birlikte, modern metrik birimler sistemi gibi bilim, teknoloji ve ticaret için pratik ölçüm sistemlerinde , makroskopik ve mikroskobik açıklamalar, sıcaklığı mikroskobik ortalama kinetik enerjiye ölçekleyen bir orantı faktörü olan Boltzmann sabiti ile ilişkilidir. .
Mikroskobik açıklama istatistiksel mekanik klasik ya da bir dizi maddenin kendi temel parçacıklar halinde ya da bir sistem analiz eden bir modele dayanan kuantum mekanik osilatörler ve sistemi olarak dikkate istatistiksel topluluğu arasında mikro- . Klasik malzeme parçacıklarının bir koleksiyonu olarak sıcaklık, katılarda, sıvılarda, gazlarda veya plazmalarda olsun, parçacıkların kinetik enerji adı verilen ortalama hareket enerjisinin bir ölçüsüdür . Klasik mekaniğin bir kavramı olan kinetik enerji, bir parçacığın kütlesinin yarısı çarpı hızının karesidir. Termal hareketin bu mekanik yorumunda, malzeme parçacıklarının kinetik enerjileri, parçacıkların öteleme veya titreşim hareketlerinin hızında veya dönme modlarının ataletinde bulunabilir. Monatomik mükemmel gazlarda ve yaklaşık olarak çoğu gazda sıcaklık, ortalama partikül kinetik enerjisinin bir ölçüsüdür. Aynı zamanda enerjinin olasılık dağılım fonksiyonunu da belirler. Yoğun maddede ve özellikle katılarda, bu tamamen mekanik tanımlama genellikle daha az kullanışlıdır ve osilatör modeli, kuantum mekanik olaylarını açıklamak için daha iyi bir tanımlama sağlar. Sıcaklık, topluluğun mikro durumlarının istatistiksel işgalini belirler. Sıcaklığın mikroskobik tanımı yalnızca termodinamik sınırda anlamlıdır , yani büyük devletler veya parçacık toplulukları için istatistiksel modelin gerekliliklerini yerine getirmek için.
Kinetik enerji de termal enerjinin bir bileşeni olarak kabul edilir . Termal enerji, bir termodinamik sistemdeki parçacıkların serbestlik derecelerine veya osilatörlerin modlarına atfedilen bağımsız bileşenlere bölünebilir . Genel olarak, enerjinin eşit olarak bölünmesi için mevcut olan bu serbestlik derecelerinin sayısı sıcaklığa, yani söz konusu etkileşimlerin enerji bölgesine bağlıdır. Katılar için, termal enerji öncelikle atomlarının veya moleküllerinin denge konumları hakkındaki titreşimleriyle ilişkilidir . Bir in yere atomlu gazların , kinetik enerji parçacıklarının saf öteleme hareketine münhasıran bulunur. Diğer sistemlerde, titreşim ve dönme hareketleri de serbestlik derecelerine katkıda bulunur.
Gazların kinetik teorisi

Maxwell ve Boltzmann , gazlarda sıcaklığın temel bir anlayışını sağlayan bir kinetik teori geliştirdi . Bu teori aynı zamanda ideal gaz yasasını ve tek atomlu (veya 'soylu' ) gazların gözlemlenen ısı kapasitesini de açıklar .
İdeal gaz yasası gözlenen dayanmaktadır ampirik ilişkiler basınç arasında ( p ), hacim ( V ) ve sıcaklık ( T ) ve gazların kinetik teorisi geliştirildi önce (bkz uzun tanındı Boyle ve Charles yasaları). İdeal gaz yasası şunları belirtir:
burada n gazın mol sayısıdır ve R = 8.314 462 618 ... J⋅mol -1 ⋅K -1 olan gaz sabiti .
Bu ilişki bize sıcaklık ölçeğinde mutlak bir sıfır olduğuna dair ilk ipucumuzu verir , çünkü yalnızca sıcaklık Kelvin'inki gibi mutlak bir ölçekte ölçüldüğünde geçerlidir . İdeal gaz yasası biri bu konuda sıcaklığını ölçmek için sağlar mutlak kullanarak ölçek gaz termometre . Kelvin cinsinden sıcaklık, bir metreküplük bir kaptaki bir mol gazın paskal cinsinden basıncının gaz sabitine bölümü olarak tanımlanabilir.
Özellikle uygun bir cihaz olmamasına rağmen, gaz termometresi , tüm termometrelerin kalibre edilebildiği temel bir teorik temel sağlar. Pratik bir mesele olarak, gazlar sıcaklık sıfıra ulaşmadan çok önce bir sıvı halinde yoğunlaşma eğiliminde olduklarından, mutlak sıfır sıcaklığını ölçmek için bir gaz termometresi kullanmak mümkün değildir. Bununla birlikte, şekilde gösterildiği gibi ideal gaz yasasını kullanarak mutlak sıfıra ulaşmak mümkündür.
Kinetik teori, basıncın, duvarlara çarpan tek tek atomlarla ilişkili kuvvetten kaynaklandığını ve tüm enerjinin öteleme kinetik enerjisi olduğunu varsayar . Boltzmann , sofistike bir simetri argümanı kullanarak, ideal bir gazdaki parçacıkların hızı için şimdi Maxwell-Boltzmann olasılık dağılım fonksiyonu olarak adlandırılan şeyi çıkardı . Bu olasılık dağılım fonksiyonundan, tek atomlu bir ideal gazın ortalama kinetik enerjisi (parçacık başına) ,
nerede Boltzmann sabiti k B ise ideal gaz sabiti bölü Avogadro sayısının ve bir kök ortalama kare hızı . Sıcaklık ve ortalama moleküler kinetik enerji arasındaki bu doğrudan orantı, eş-bölme teoreminin özel bir durumudur ve sadece mükemmel gazın klasik limitinde geçerlidir . Çoğu madde için tam olarak geçerli değildir.
termodinamiğin sıfırıncı yasası
Aksi takdirde izole edilmiş iki cisim, maddeyi geçirmeyen katı bir fiziksel yolla birbirine bağlandığında, enerjinin sıcaktan soğuğa kendiliğinden ısı transferi olur. Sonunda, ısı transferinin durduğu ve cisimlerin ilgili durum değişkenlerinin değişmez hale geldiği karşılıklı bir termal denge durumuna ulaşırlar .
Bir deyim termodinamiğin sıfırıncı yasası iki sistem üçüncü bir sistemle termal denge her ise, o zaman birbirleri ile ısıl dengede da olmasıdır.
Bu ifade sıcaklığı tanımlamaya yardımcı olur, ancak kendi başına tanımı tamamlamaz. Ampirik sıcaklık, bir termodinamik sistemin sıcaklığı için sayısal bir ölçektir. Bu tür bir sıcaklık, sıcak ve soğuk arasında uzanan tek boyutlu bir manifold üzerinde mevcut olarak tanımlanabilir . Bazen sıfırıncı yasanın, ampirik sıcaklığın tam bir tanımını sağlamak için benzersiz bir evrensel sıcaklık manifoldunun ve bunun üzerindeki sayısal ölçeklerin varlığını içerdiği belirtilir. Ampirik termometriye uygun olması için, bir malzemenin, diğer tüm ilgili koordinatlar sabitlendiğinde, sıcaklık ile basınç veya hacim gibi kolayca ölçülebilen bazı durum değişkenleri arasında monotonik bir ilişkiye sahip olması gerekir. Son derece uygun bir sistem, mutlak Kelvin ölçeğine uyan bir sıcaklık ölçeği sağlayabilen ideal gazdır . Kelvin ölçeği, termodinamiğin ikinci yasası temelinde tanımlanır.
Termodinamiğin ikinci yasası
Termodinamiğin sıfırıncı yasasını dikkate almaya veya tanımlamaya bir alternatif olarak, sıcaklığı entropi ile ilgilenen termodinamiğin ikinci yasası cinsinden tanımlamak termodinamiğin tarihsel gelişimiydi . İkinci yasa, herhangi bir sürecin, evrenin entropisinde ya hiçbir değişikliğe ya da net bir artışa neden olmayacağını belirtir. Bu olasılık açısından anlaşılabilir.
Örneğin, bir dizi yazı turasında, mükemmel bir şekilde düzenlenmiş bir sistem, ya her atışın tura geldiği ya da her atışın tura geldiği bir sistem olacaktır. Bu, sonucun her zaman %100 aynı sonuç olduğu anlamına gelir. Buna karşılık, birçok karışık ( düzensiz ) sonuç mümkündür ve sayıları her atışta artar. Sonunda, ~%50 tura ve ~%50 tura kombinasyonları hakimdir ve 50/50'den önemli ölçüde farklı bir sonuç elde etmek giderek daha olası hale gelir. Böylece sistem doğal olarak maksimum düzensizlik veya entropi durumuna ilerler.
Sıcaklık, iki sistem arasındaki ısı transferini yönettiğinden ve evren maksimum entropiye doğru ilerleme eğiliminde olduğundan, sıcaklık ile entropi arasında bir ilişki olması beklenir. Bir ısı motoru , termal enerjiyi mekanik enerjiye dönüştüren ve işin performansıyla sonuçlanan bir cihazdır. ve Carnot ısı makinesinin analizi gerekli ilişkileri sağlar. Bir ısı makinesinden gelen iş, sisteme yüksek sıcaklıkta q H verilen ısı ile düşük sıcaklıkta q C çıkarılan ısı arasındaki farka karşılık gelir .
Verimlilik, işin ısı girdisine bölümüdür:
-
(4)
burada w cy döngü başına yapılan iştir. Verimlilik sadece q C / q H'ye bağlıdır . Çünkü q C ve q, lH sıcaklıklarında ısı aktarımı için karşılık gelir , T Cı- ve T , H , sırasıyla, q C / q , H , bu sıcaklıkların bir fonksiyonu olması gerekir:
-
(5)
Carnot teoremi , aynı ısı rezervuarları arasında çalışan tüm tersinir motorların eşit derecede verimli olduğunu belirtir. Bu nedenle, sıcak arasında ısı motor çalışma T 1 ve T 3 , iki döngü arasında bir oluşan aynı verimliliğe sahip olması gerekir , T 1 ve T 2 arasında ve ikinci T 2 ve T 3 . Bu ancak şu durumlarda olabilir:
Hangi ima
İlk fonksiyon T 2 'den bağımsız olduğundan , bu sıcaklık sağ tarafta iptal edilmelidir, yani f ( T 1 , T 3 ) g ( T 1 )/ g ( T 3 ) (yani f ( T 1 , T 3 ) = f ( T 1 , T 2 ) f ( T 2 , T 3 ) = g ( T 1 )/ g ( T 2 ) · g ( T 2 )/ g ( T 3 ) = g ( T 1 ) / g ( T 3 ) ) , burada g tek bir sıcaklığın bir fonksiyonudur. Artık şu özelliğe sahip bir sıcaklık ölçeği seçilebilir:
-
(6)
(6)'yı (4)'e geri koymak, sıcaklık açısından verimlilik için bir ilişki verir:
-
(7)
İçin T C = 0 K ve randımanın% 100 olduğunu ve bu etkinlik 0, aşağıda daha fazla% 100 olur , bu 0 anlamına gelir,% 100 Termodinamiğin birinci yasaları ihlal daha bir etkinlik büyük olması K. K minimum sıcaklıktır. Aslında, makroskopik bir sistemde şimdiye kadar elde edilen en düşük sıcaklık , 1995 yılında NIST'de elde edilen 20 nK idi. (5)'in sağ tarafının orta kısımdan çıkarılması ve yeniden düzenlenmesi,
burada negatif işaret sistemden atılan ısıyı gösterir. Bu ilişki, S ile tanımlanan bir durum fonksiyonunun varlığını gösterir .
-
(8)
burada alt simge tersine çevrilebilir bir işlemi gösterir. Bu durum fonksiyonunun herhangi bir döngü etrafındaki değişimi, herhangi bir durum fonksiyonu için gerekli olduğu gibi sıfırdır. Bu fonksiyon, daha önce açıklanan sistemin entropisine karşılık gelir. Yeniden düzenleme (8), entropi ve ısının hayali sonsuz küçük yarı-tersinir elemanları cinsinden sıcaklık için bir formül verir:
-
(9)
Entropinin S ( E ) enerjisinin E bir fonksiyonu olduğu bir sistem için, T sıcaklığı şu şekilde verilir:
-
(10)
yani sıcaklığın tersi, enerjiye göre entropinin artış hızıdır.
İstatistiksel mekanikten tanım
İstatistiksel mekanik , bir sistemin temel serbestlik derecelerine dayalı olarak sıcaklığı tanımlar. Denklem (10), entropinin , verilen makro durumda ( mikrokanonik toplulukta belirtildiği gibi) sistemin mikro durum sayısının logaritması ile tanımlandığı (bir sabite kadar) sıcaklığın tanımlayıcı ilişkisidir :
nerede Boltzmann sabiti ve N , mikro durum sayısıdır.
Farklı sıcaklıklara sahip iki sistem tamamen termal bağlantıya getirildiğinde, ısı daha yüksek sıcaklıktaki sistemden daha düşük sıcaklıktaki sisteme akacaktır; termodinamik olarak bu, termodinamiğin ikinci yasası ile anlaşılır: 1. sistemden 2. sisteme bir enerji transferini takiben entropideki toplam değişim :
ve bu nedenle pozitif ise
İstatistiksel mekanik açısından, birleşik sistem 1 + sistem 2'deki toplam mikro durum sayısı , logaritması (Boltzmann sabitinin çarpımı) entropilerinin toplamıdır; bu nedenle, toplam entropide bir artışa neden olan yüksek sıcaklıktan düşük sıcaklığa doğru bir ısı akışı, elde edilen makro durumda daha fazla mikro durum olduğundan, diğer tüm senaryolardan daha olasıdır (normalde çok daha olasıdır).
Tek parçacık istatistiklerinden genelleştirilmiş sıcaklık
Sıcaklığın tanımını kuantum noktasında olduğu gibi birkaç parçacıktan oluşan sistemlere kadar genişletmek mümkündür . Genelleştirilmiş sıcaklık, tek/çift doluluk sistemi ile küçük bir fermiyon sistemi ( N hatta 10'dan az) arasındaki termal ve parçacık değişimi durumunda istatistiksel mekanikte verilen konfigürasyon-uzay toplulukları yerine zaman toplulukları dikkate alınarak elde edilir . Ergodiklik ve ortodiklik hipotezi altında elde edilen sonlu kuantum büyük kanonik topluluk , ortalama işgal süresi ve tek/çift kişilik sistem oranından genelleştirilmiş sıcaklığı ifade etmeye izin verir :
burada E F olan Fermi enerjisi . Bu genelleştirilmiş sıcaklık, N sonsuza gittiğinde normal sıcaklığa yönelir.
Negatif sıcaklık
Mutlak sıfıra atıfta bulunulmayan ampirik sıcaklık ölçeklerinde, negatif sıcaklık, kullanılan ölçeğin sıfır noktasının altındadır. Örneğin kuru buz , süblimleşme sıcaklığına sahiptir.-78.5 °C , eşdeğerdir-109,3 °F . Mutlak Kelvin ölçeğinde bu sıcaklık194.6 K . Hiçbir beden tam olarak getirilemezHerhangi bir sonlu uygulanabilir süreçle 0 K (mümkün olan en soğuk cismin sıcaklığı); bu termodinamiğin üçüncü yasasının bir sonucudur .
Bir cismin uluslararası kinetik teori sıcaklığı negatif değerler alamaz. Bununla birlikte, termodinamik sıcaklık ölçeği bu kadar kısıtlı değildir.
Bir madde cismi için, bazen kavramsal olarak, mikroskobik serbestlik dereceleri, yani parçacık dönüşleri, tüm cismin sıcaklığından farklı bir sıcaklığa sahip bir alt sistem olarak tanımlanabilir. Cisim kendi iç termodinamik denge durumundayken, tüm cismin ve alt sistemin sıcaklıkları aynı olmalıdır. İki sıcaklık, harici olarak uygulanan kuvvet alanları aracılığıyla çalışarak, vücudun geri kalanından ayrı olarak alt sisteme ve alt sistemden enerji aktarılabildiğinde farklılık gösterebilir; o zaman tüm vücut kendi iç termodinamik denge durumunda değildir. Böyle bir spin alt sisteminin ulaşabileceği bir üst enerji limiti vardır.
Alt sistemin geçici bir sanal termodinamik denge durumunda olduğu düşünüldüğünde, termodinamik ölçekte negatif bir sıcaklık elde etmek mümkündür . Termodinamik sıcaklık, alt sistemin iç enerjisine göre entropisinin türevinin tersidir. Alt sistemin iç enerjisi arttıkça, entropi belirli bir aralık için artar, ancak sonunda maksimum bir değere ulaşır ve ardından en yüksek enerji durumları dolmaya başladığında azalmaya başlar. Maksimum entropi noktasında, sıcaklık fonksiyonu bir tekillik davranışı gösterir , çünkü entropi fonksiyonunun eğimi sıfıra düşer ve sonra negatife döner. Alt sistemin entropisi maksimuma ulaştığında, termodinamik sıcaklığı pozitif sonsuza gider, eğim negatife döndükçe negatif sonsuza geçer. Bu tür negatif sıcaklıklar, herhangi bir pozitif sıcaklıktan daha sıcaktır. Zamanla, alt sistem pozitif sıcaklığa sahip vücudun geri kalanına maruz kaldığında, enerji negatif sıcaklık alt sisteminden pozitif sıcaklık sistemine ısı olarak aktarılır. Kinetik teori sıcaklığı, bu tür alt sistemler için tanımlanmamıştır.
Örnekler
| Sıcaklık | Tepe emittans dalga boyu arasında kara cisim radyasyon |
||
|---|---|---|---|
| Kelvin | Santigrat | ||
|
Mutlak sıfır (tam olarak tanım gereği) |
0 bin | -273,15 °C | tanımlanamaz |
Galaksimizin merkezindeki kara deliğin kara cisim sıcaklığı , Yay A* |
17 saat | −273.149 999 999 999 983 °C | 1,7 × 10 8 km (1.1 AU ) |
| Elde edilen en düşük sıcaklık |
100 pK | −273.149 999 999 900 °C | 29 000 km |
| En soğuk Bose-Einstein yoğuşması |
450 pK | −273.149 999 999 55 °C | 6400 km |
| Bir millikelvin (tam olarak tanım gereği) |
0,001 bin | -273.149 °C |
2.897 77 m (radyo, FM bandı ) |
|
Kozmik mikrodalga arka plan (2013 ölçümü) |
2.7260 bin | −270.424 °C |
0.001 063 01 m (milimetre dalga boyu mikrodalga) |
|
Su üçlü noktası (tam olarak tanım gereği) |
273.16 Bin | 0,01 °C |
10 608 .3 nm (uzun dalga boylu IR ) |
| Su kaynama noktası | 373,1339 Bin | 99.9839 °C |
7 766 .03 nm (orta dalga boyu IR) |
| Demir erime noktası | 1811 bin | 1538 °C |
1600 nm ( uzak kızılötesi ) |
| Akkor lamba | 2500 bin | ≈2200 °C |
1160 nm (yakın kızılötesi ) |
| Güneşin görünür yüzeyi | 5778 bin | 5505 °C |
501.5 nm ( yeşil-mavi ışık ) |
|
Şimşek kanalı |
28 kK | 28 000 °C |
100 nm (uzak ultraviyole ışık) |
| Güneş'in çekirdeği | 16 milyon TL | 16 milyon °C | 0.18 nm ( X-ışınları ) |
|
Termonükleer silah (en yüksek sıcaklık) |
350 milyon TL | 350 milyon °C | 8.3×10 −3 nm ( gama ışınları ) |
| Sandia Ulusal Laboratuarlarının Z makinesi |
2 gün | 2 milyar °C | 1.4×10 −3 nm (gama ışınları) |
| Son gününde yüksek kütleli bir yıldızın çekirdeği |
3 gün | 3 milyar °C | 1×10 −3 nm (gama ışınları) |
| İkili nötron yıldız sistemini birleştirme |
350 TL | 350 milyar °C |
8 × 10 −6 nm (gama ışınları) |
|
Göreli Ağır İyon Çarpıştırıcısı |
1 TL | 1 trilyon °C |
3 × 10 −6 nm (gama ışınları) |
|
CERN'in proton ve çekirdek çarpışmaları |
10 TL | 10 trilyon °C |
3 × 10 −7 nm (gama ışınları) |
| Evren Büyük Patlama'dan 5,391 × 10 −44 s sonra |
1.417 × 10 32 K ( Planck sıcaklığı ) |
1.417 × 10 32 °C |
1.616 × 10 −27 nm ( Planck uzunluğu ) |
Ayrıca bakınız
- atmosfer sıcaklığı
- Vücut ısısı - Bir organizmanın vücut sıcaklığını belirli sınırlar içinde tutma yeteneği (termoregülasyon)
- Renk sıcaklığı – Kara cisim ışımasıyla ilgili ışık kaynaklarının özelliği
- Kuru termometre sıcaklığı
- Termal iletim - Parçacık çarpışmaları ve elektron hareketleri nedeniyle bir vücut içindeki iç enerjinin transferi
- konvektif ısı transferi
- Enstrümantal sıcaklık kaydı - Dünya'nın iklim sisteminin sıcaklığını sağlayan yerinde ölçümler
- ISO 1
- 1990 Uluslararası Sıcaklık Ölçeği (ITS-90)
- Lazer schlieren deflektometri
- Ortalama sıcaklığa göre şehirlerin listesi
- Maxwell'in iblisi – 1867'nin düşünce deneyi
- Büyüklük dereceleri (sıcaklık) – Mutlak sıfırdan çok yükseğe sıcaklık aralığı
- Dış hava sıcaklığı
- Planck sıcaklığı
- Rankine ölçeği – Fahrenheit derecelerini kullanan mutlak sıcaklık ölçeği
- Göreli ısı iletimi - Isı iletimi ve benzeri difüzyon işlemlerinin özel görelilik ile uyumlu bir şekilde modellenmesi.
- Uydu sıcaklık ölçümleri
- Sıcaklık ölçeği
- Deniz yüzey sıcaklığı – Okyanus yüzeyine yakın su sıcaklığı
- Durgunluk sıcaklığı
- Termal radyasyon – Parçacıkların termal hareketiyle üretilen elektromanyetik radyasyon
- Termosepsiyon – Bir ısı akışından elde edilen ve moleküler bir sinyale dönüştürülen sıcaklık uyarısı
- Termodinamik (mutlak) sıcaklık – Mutlak sıcaklığın ölçümü
- Termografi – Yapılardaki veya bölgelerdeki ısı dağılımını incelemek için termogramların kullanılması
- Termometre – Sıcaklığı ölçmek için cihaz
- sanal sıcaklık
- Yaş termometre küre sıcaklığı
- Islak termometre sıcaklığı - Suya batırılmış bir bezle kaplı bir termometre tarafından okunan sıcaklık
Notlar ve referanslar
Atıf yapılan referansların bibliyografyası
- Adkins, CJ (1968/1983). Equilibrium Thermodynamics , (1. baskı 1968), üçüncü baskı 1983, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0 .
- Buchdahl, HA (1966). Klasik Termodinamik Kavramları , Cambridge University Press, Cambridge.
- Jaynes, ET (1965). Gibbs vs Boltzmann entropileri, American Journal of Physics , 33 (5), 391-398.
- Middleton, HAFTA (1966). Termometrenin Tarihi ve Metrolojide Kullanımı , Johns Hopkins Press, Baltimore.
- Miller, J (2013). "Molekülleri optoelektrik yolla soğutma" . Fizik Bugün . 66 (1): 12–14. Bibcode : 2013PhT....66a..12M . doi : 10.1063/pt.3.1840 . Arşivlenmiş orijinal 2016-05-15 tarihinde.
- Partington, JR (1949). Fiziksel Kimya Üzerine Gelişmiş Bir İnceleme , cilt 1, Temel İlkeler. Gazların Özellikleri , Longmans, Green & Co., Londra, s. 175–177.
- Pippard, AB (1957/1966). Elements of Classical Thermodynamics for Advanced Students of Physics , orijinal yayın 1957, yeniden basım 1966, Cambridge University Press, Cambridge UK.
- Quinn, TJ (1983). Sıcaklık , Academic Press, Londra, ISBN 0-12-569680-9 .
- Schooley, JF (1986). Termometri , CRC Press, Boca Raton, ISBN 0-8493-5833-7 .
- Roberts, JK, Miller, AR (1928/1960). Isı ve Termodinamik , (birinci baskı 1928), beşinci baskı, Blackie & Son Limited, Glasgow.
- Thomson, W. (Lord Kelvin) (1848). Carnot'un ısının itici gücü teorisine dayanan ve Regnault'un gözlemlerinden hesaplanan mutlak bir termometrik ölçekte, Proc. Camb. Phil. Soc. (1843/1863) 1 , No. 5: 66-71.
- Thomson, W. (Lord Kelvin) (Mart 1851). "Dinamik Isı Teorisi Üzerine, Bay Joule'nin Termal Birim eşdeğerinden ve M. Regnault'un Buhar Üzerine Gözlemlerinden elde edilen sayısal sonuçlarla". Royal Society of Edinburgh'un İşlemleri . XX (bölüm II): 261–268, 289–298.
- Truesdell, CA (1980). Termodinamiğin Trajikomik Tarihi, 1822-1854 , Springer, New York, ISBN 0-387-90403-4 .
- Tschoegl, KB (2000). Denge ve Kararlı Hal Termodinamiğinin Temelleri , Elsevier, Amsterdam, ISBN 0-444-50426-5 .
- Zeppenfeld, M.; Englert, BGU; Glöckner, R.; Prehn, A.; Mielenz, M.; Sommer, C.; van Buuren, LD; Motsch, M.; Rempe, G. (2012). "Elektriksel olarak kapana kısılmış çok atomlu moleküllerin Sysiphus soğutması". Doğa . 491 (7425): 570-573. arXiv : 1208.0046 . Bibcode : 2012Natur.491..570Z . doi : 10.1038/nature11595 . PMID 23151480 . S2CID 4367940 .
daha fazla okuma
- Chang, Hasok (2004). Sıcaklığın Keşfi: Ölçüm ve Bilimsel İlerleme . Oxford: Oxford University Press. ISBN 978-0-19-517127-3 .
- Zemansky, Mark Waldo (1964). Sıcaklıklar Çok Düşük ve Çok Yüksek . Princeton, NJ: Van Nostrand.